肺脏(Lung)是哺乳动物呼吸系统中最重要的器官,其主要功能是将氧气送入血液,并将二氧化碳排出体外,除呼吸调节功能外、肺脏还承载着防疫、免疫、肺循环、造血等多种重要的功能。肺脏包括支气管、小(细)支气管、肺泡管和肺泡,肺泡是支气管树的终末部分,是肺部气体交换的主要部分,也是肺的功能单位。
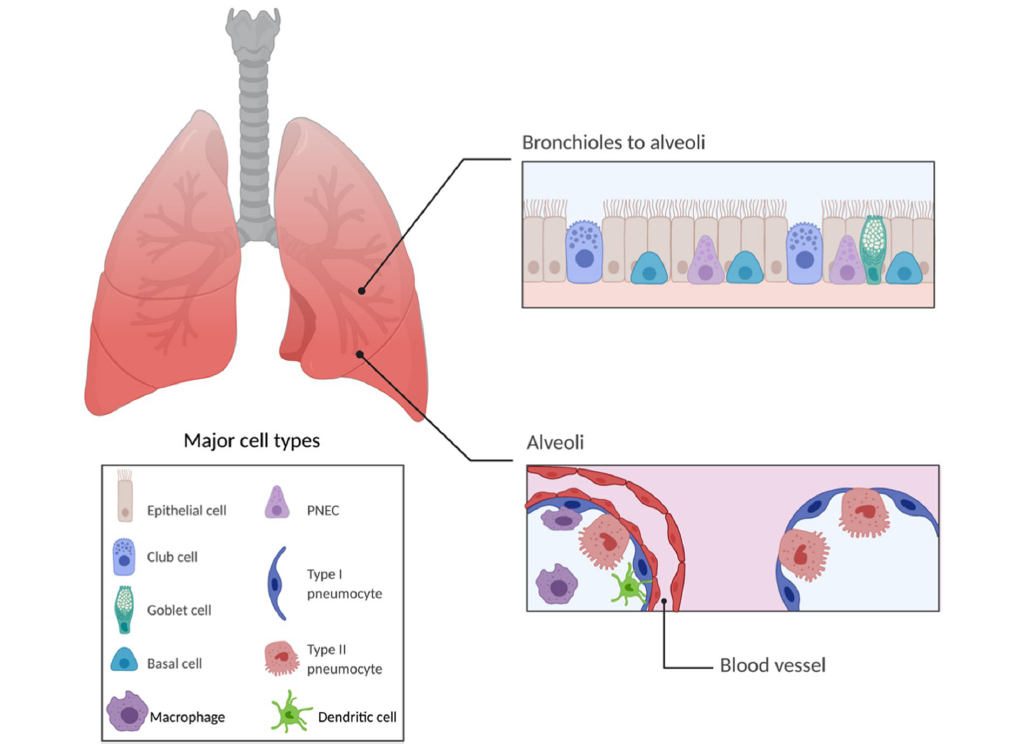
肺脏结构及主要细胞类型
(Siqin He, et al., J Nanobiotechnology, 2022)
呼吸系统疾病是危害全世界人民健康的常见疾病之一,其中不乏由基因突变导致的肺部疾病,如慢性阻塞性肺疾病、支气管炎、家族性肺纤维化、囊性纤维化等,这些疾病的遗传机制已经被深入研究,但仍然缺乏有效的治疗方案,导致病情进一步恶化引发呼吸系统损伤,甚至是死亡。
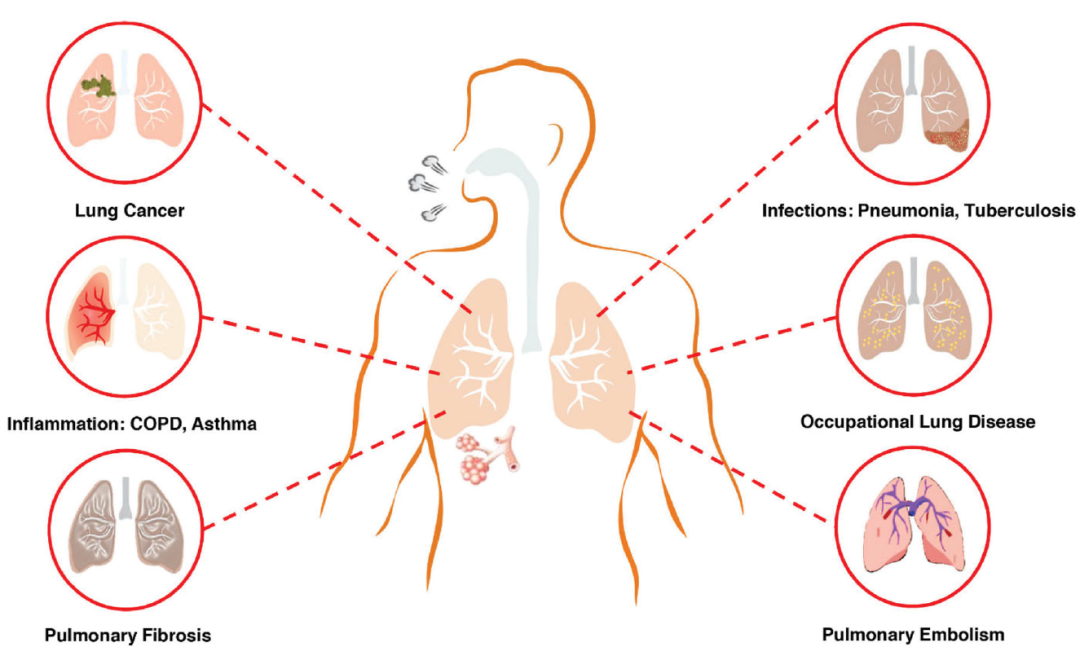
主要呼吸系统疾病类型
(Jesus Shrestha, et al., Crit Rev Biotechnol, 2020)
重组腺相关病毒载体(recombinant Adeno-associated virus, rAAV)具有血清型种类多样、免疫原性低、长期稳定表达基因、宿主范围广等优势,在基因功能研究和基因治疗递送载体中占据主导地位。基于转基因动物的局限性,借助rAAV载体高效感染肺脏用于肺部疾病的建模和治疗策略已成为越来越多研究者的选择。

1、AAV血清型的选择
目前AAV1、AAV2、AAV5、AAV6、AAV6.2ff、AAV9等血清型均被报道可以转导动物肺脏,基于血清型嗜性、注射方式及研究对象的不同,这些AAV对于肺脏的转导效率及感染部位也表现出差异。如AAV9经气管注射主要感染肺泡上皮细胞,对于支气管上皮细胞的感染极少;AAV6和AAV6.2ff经气管注射可以高效转导支气管和肺泡上皮细胞,且在肺类器官中也表现出良好的感染效率,这几种AAV也是目前用于肺部基因递送用的较多的血清型。
肺实质是治疗肺部遗传性疾病如表面活性物质缺乏和间质性肺疾病的关键目标,特别是肺泡II型上皮细胞(alveolar type II,ATⅡ),其表达对表面活性剂功能至关重要的蛋白质,参与免疫反应以及转分化等多种功能,是肺部疾病基因治疗的靶细胞群体。最近,由玮美基因自主创建的AAVmeta载体开发平台,开发了一种具有自主知识产权的新型AAV递送载体--AAV-LungM3,该血清型在小鼠模型中以低病毒量实现气管注射高效转导肺脏、亲嗜感染ATII(点击链接,了解详情)。
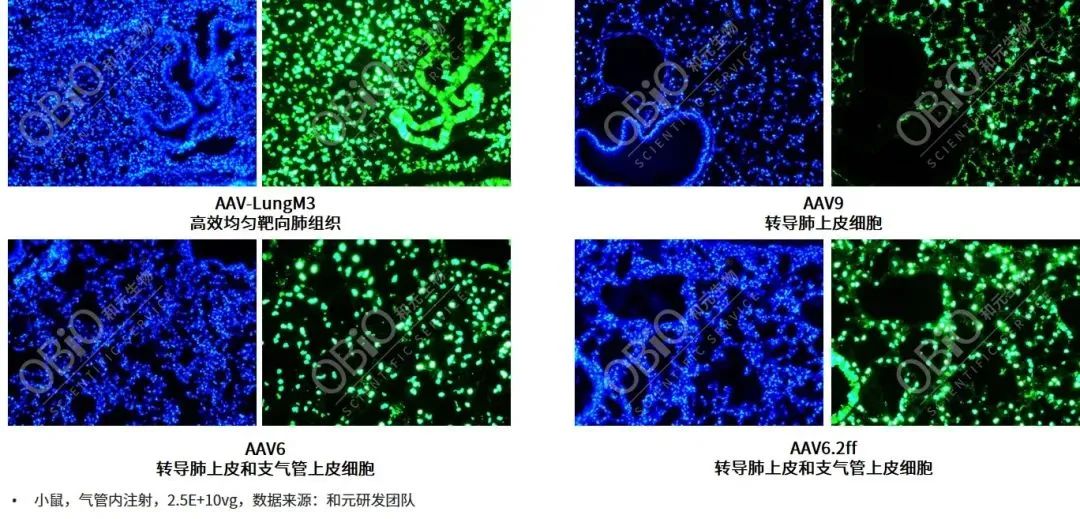
AAV不同血清型气管内注射肺部基因递送转导效率比较(低剂量,2.5E+10vg)
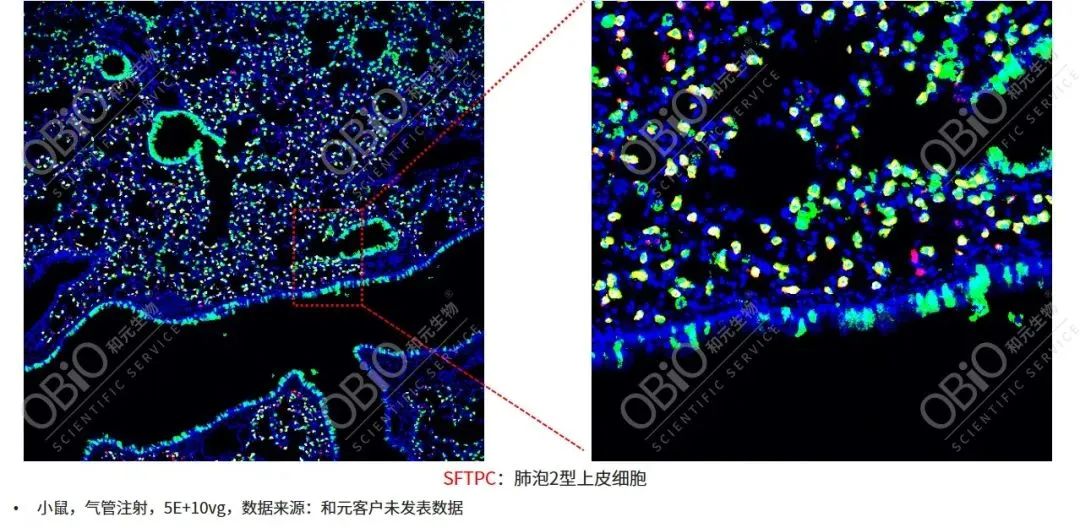 AAV-LungM3气管注射靶向ATII
AAV-LungM3气管注射靶向ATII
肺脏是一个高度血管化的器官,主要功能是促进氧气通过血流的转移,在这过程中,肺部内皮细胞(endothelial cells, ECs)至关重要。研究发现,ECs的功能异常往往参与多种肺部疾病的发生发展,如慢性阻塞性肺病、肺纤维化、肺动脉高压、肺炎、急性呼吸窘迫综合征、自身免疫性疾病等。和元生物自主创建的AAVneO®全新AAV血清型发现平台,开发了一种具有自主知识产权的新型AAV递送载体--AAV-LungX,该血清型在小鼠模型中以较低剂量的病毒颗粒实现静脉注射,高效转导肺脏且精准靶向肺内皮细胞(endothelial cells, ECs),同时基本不会在肝脏富集(点击链接,了解详情),避免了可能引起的肝毒性等副作用,为研究肺部疾病提供了一种更安全、更有效的递送载体。
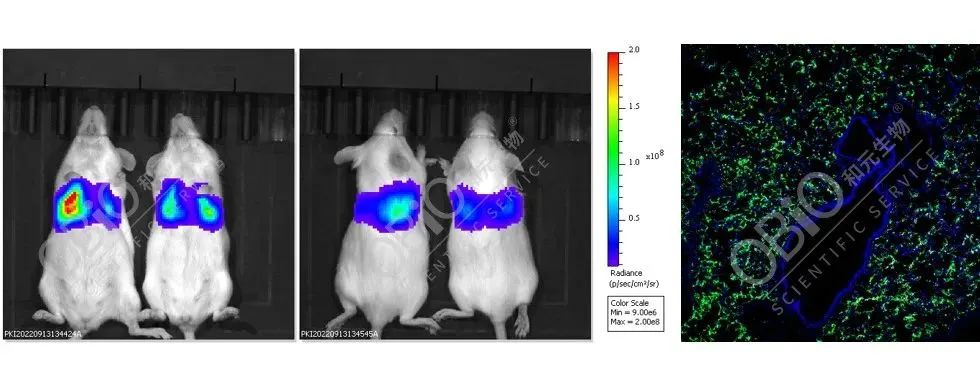 AAV-LungX尾静脉注射肺脏转导(5E+11vg/只,左:小动物活体成像结果;右:荧光结果)
AAV-LungX尾静脉注射肺脏转导(5E+11vg/只,左:小动物活体成像结果;右:荧光结果)
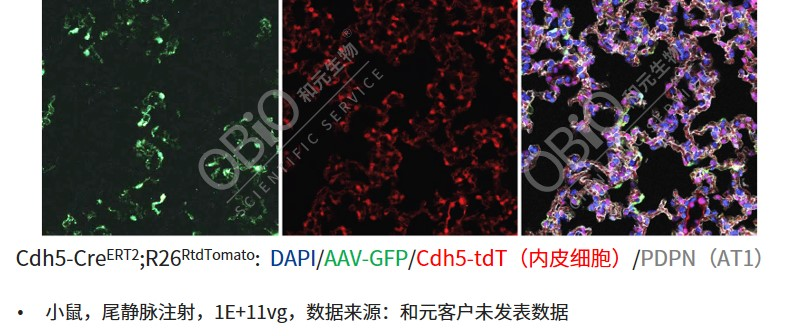
AAV-LungX尾静脉注射靶向ECs
2、启动子选择
除了上述提到的基于AAV血清型嗜性外,亦可以借助细胞特异性启动子完成特异性靶向操作。如对于肺泡II型上皮细胞的特异性感染可以借助SP-C(surfactant protein C)特异启动子实现,此外,hFLT1或Tie1可以实现内皮细胞的感染,SM22a用于血管平滑肌的特异性感染。
3、注射方式的选择及病毒注射量
对于肺部的病毒感染,一般递送途径包括两类:系统注射(经血液循环)、鼻内或气管内递送(经呼吸道)。系统注射会同时感染其他脏器,病毒被稀释,使得靶向肺脏的病毒减少,因此需要考虑血清型的选择,如AAV-LungX,经静脉注射可以实现特异靶向肺脏内皮细胞的高效转导;呼吸道递送可以实现最大程度的特异性递送,并实现肺部的高效表达,同时降低病毒剂量,但会有操作难度限制,且可能导致感染不均匀,有手术风险等缺陷。
不同注射方式比较
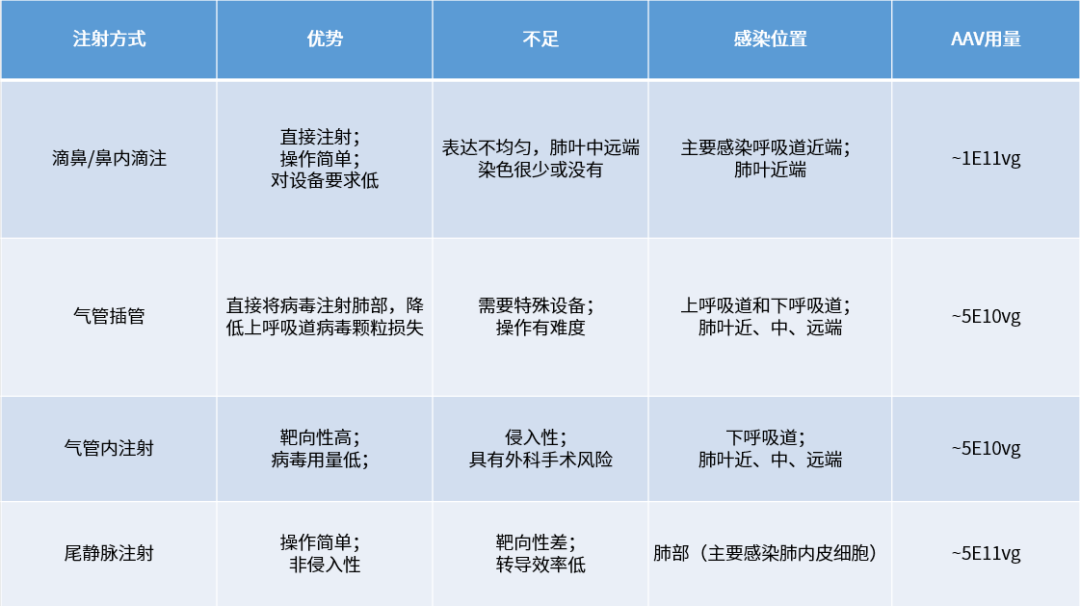
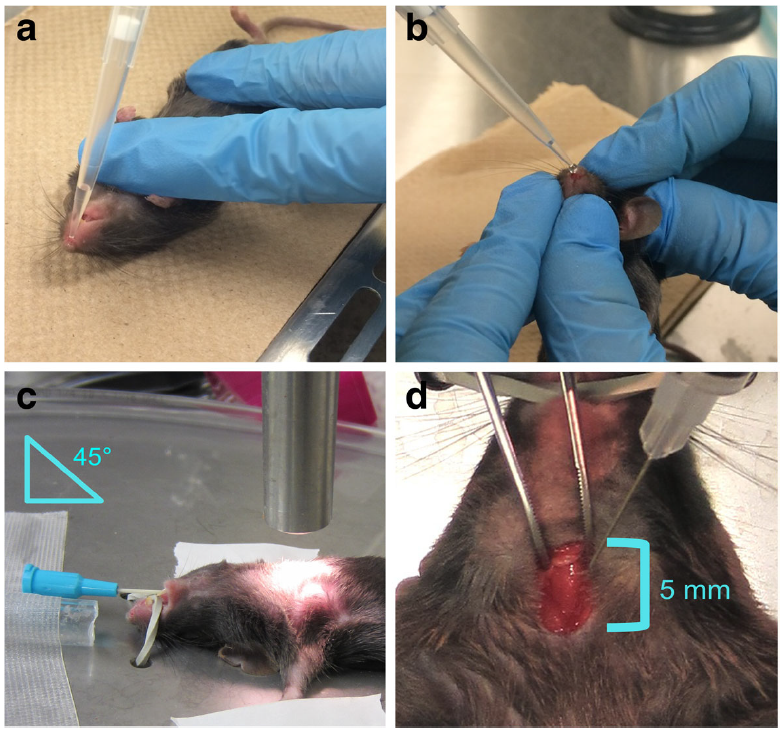
肺脏基因递送给药方式
(Lisa A. Santry et al., BMC Bio. 2017)
肺脏研究”星“手段
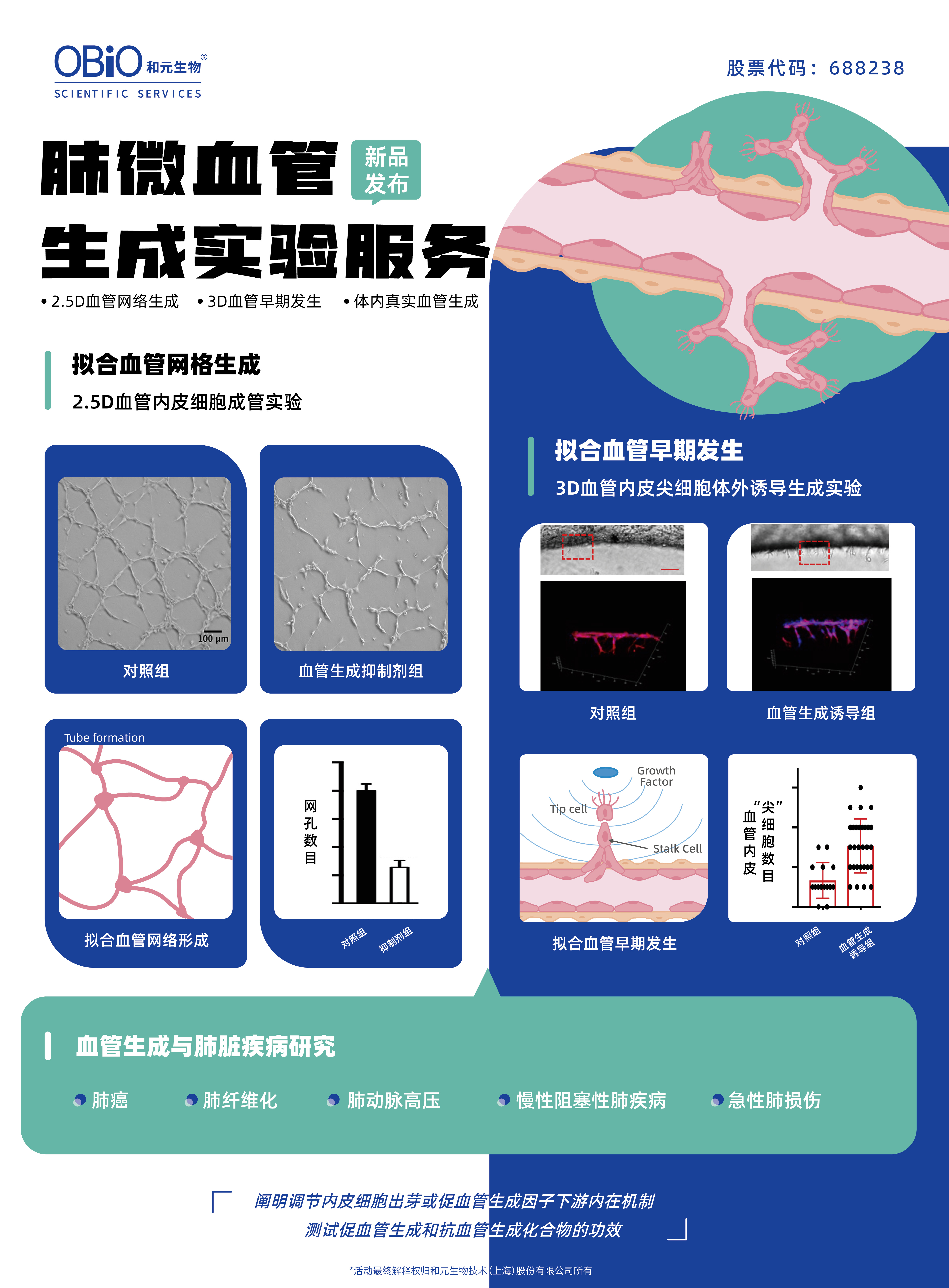
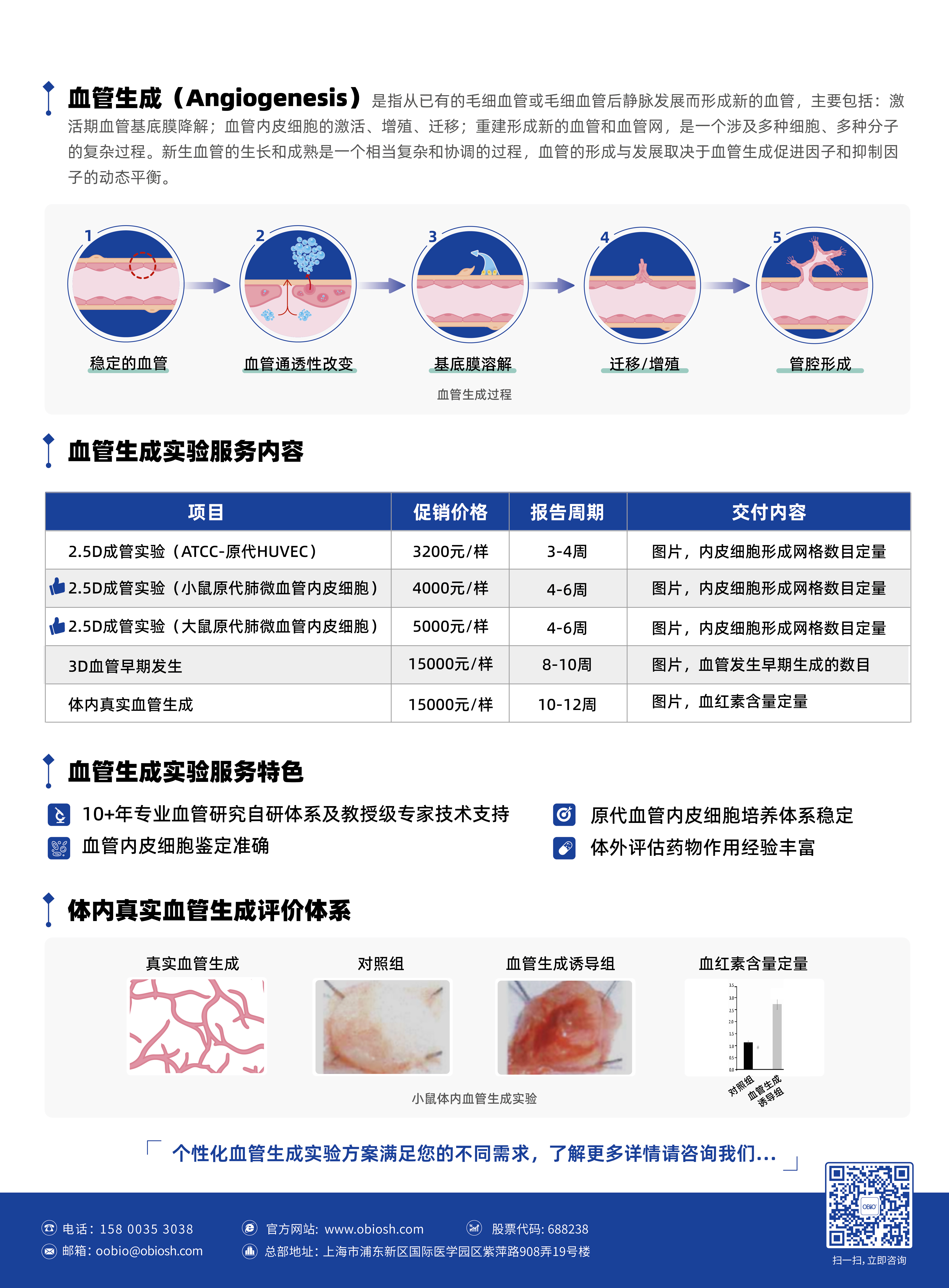
和元生物携手拥有10+年专业血管研究经验科研团队,重磅推出肺原代微血管内皮细胞血管生成实验服务,
包括2.5D血管内皮细胞成管实验、3D血管内皮尖细胞体外诱导生成实验、小鼠体内血管生成实验。
助您阐明调节内皮细胞出芽和促血管生成因子下游的细胞内机制,进一步探究疾病与血管生成之间的密切关系。
同时,也可用于测试促血管生成和抗血管生成化合物的功效,为逆转病理过程寻找新的潜在可能。
4、应用案例
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease ,COPD)是一种慢性炎症性疾病,已成为全球第四大常见死因。2022年华中科技大学同济医学院谢俊刚教授团队在Oxidative Medicine and Cellular Longevity杂志发表的工作中,借助rAAV载体介导MTMR14在COPD小鼠肺部过表达,并进一步验证发现MTMR14过表达可以抑制小鼠COPD的进展。
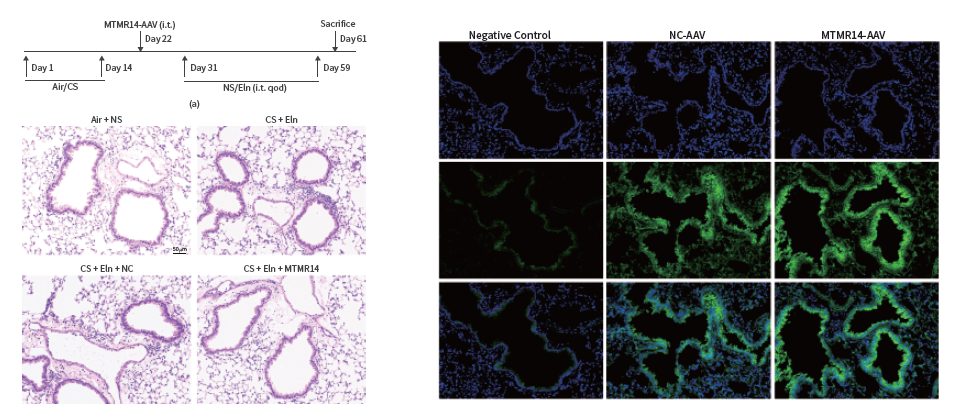
AAV经气管内注射介导MTMR14在小鼠肺部高表达(Yiya Gu, et al., Oxid Med Cell Longev, 2022)
|
病毒产品 |
AAV-MTMR14 |
|
实验动物 |
小鼠 |
|
注射方式 |
气管内注射 |
|
感染部位 |
肺脏 |
|
病毒用量 |
2E+11VG, 50μL |
|
检测时间 |
31天 |
2019冠状病毒病(COVID-19)是一种由严重急性呼吸道综合征冠状病毒2型(SARS-CoV-2)引发的传染病,是一场全球性公共卫生危机。SARS-CoV-2的核衣壳蛋白(Nucleocapsid,N蛋白)在病毒生命周期的多个步骤中发挥关键作用。2021年8月,Nature Communications杂志刊登了暨南大学吴建国教授团队的工作,该研究揭示了SARS-CoV-2 N蛋白通过NLRP3炎症小体诱导肺损伤的新机制。文中,研究团队借助AAVlung经尾静脉注射在小鼠肺部高表达N蛋白(AAVlung-N)发现过表达N蛋白后,可显著增加IL-1β,IL-6,TNF,CXLC10,CCL2等炎症因子的表达,且肺部有明显的炎症病变及组织损伤。
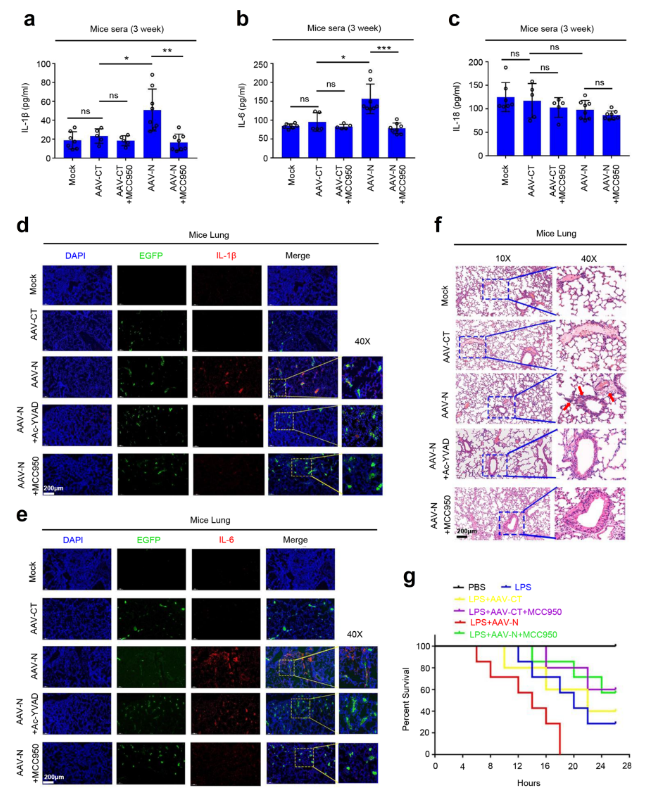
AAVLung-N尾静脉注射介导小鼠肺部过表达的N蛋白通过激活NLRP3炎性体诱导小鼠肺损伤
(Pan Pan, et al., Nat Commun, 2021)
2023年5月,暨南大学吴建国教授团队成员再添力作,由潘攀/李永奎/陈欣联合在Signal Transduction and Targeted Therapy杂志发表最新研究论文。文中,研究团队再次运用AAVlung血清型在小鼠肺部高表达N蛋白,揭示了新冠病毒通过N蛋白抑制细胞凋亡促进病毒复制的分子机制,为新冠病毒的高效传播和感染致病机理提供了新的认识。
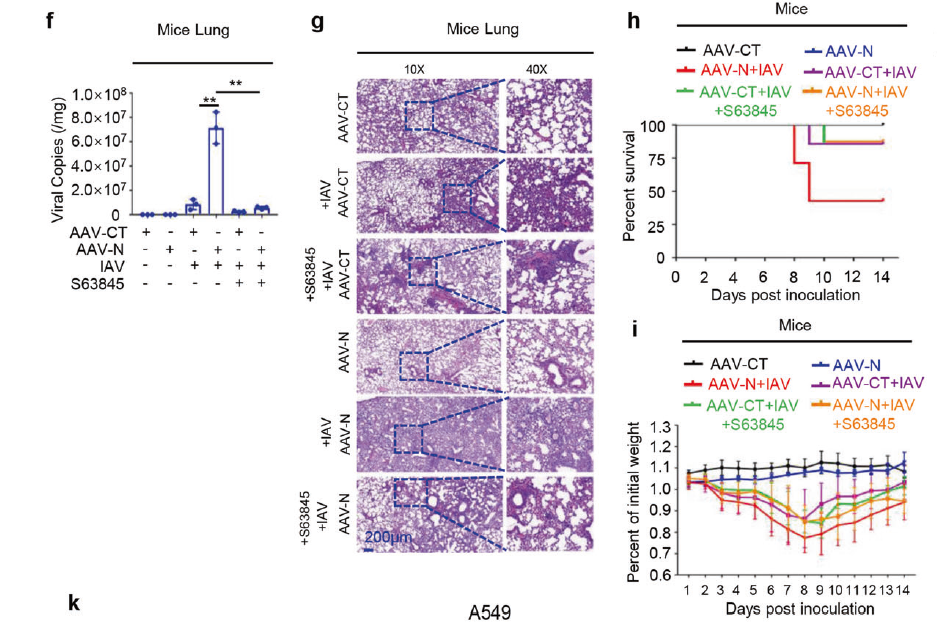
借助AAVlung血清型尾静脉注射靶向肺组织
(Pan Pan, et al., Signal Transduct Target Ther, 2023)
|
病毒产品 |
AAV-Lung-N-EGFP |
|
实验动物 |
小鼠 |
|
注射方式 |
尾静脉注射 |
|
感染部位 |
肺脏 |
|
病毒用量 |
5E+11VG |
特发性肺纤维化(Idiopathic Pulmonary Fibrosis, IPF)是一种常见的肺泡疾病,被称作“不是癌症的癌症”。2019年12月,北京生命科学研究所/清华大学生物医学交叉研究院汤楠实验室在Cell杂志上发表研究论文。文中,作者借助了病毒载体介导的基因表达调控策略,通过气管内插管的方式将rAAV2/9-Tgfb1 shRNA注射到PNX处理的Cdc42缺失小鼠的肺部,以下调的Tgfb1表达,并配合多种实验手段发现,AT2细胞中激活的TGF-b信号对于机械性张力驱动的肺纤维化的进展至关重要。
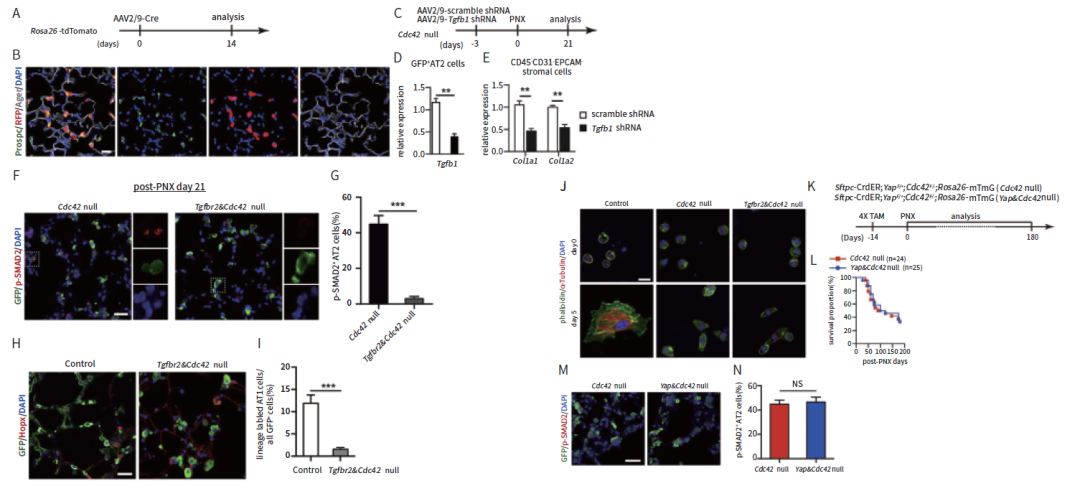
rAAV载体介导Tgfb1表达下调
(Huijuan Wu, et al., Cell, 2019)
|
病毒产品 |
rAAV2/9-Tgfb1 shRNA |
|
实验动物 |
小鼠 |
|
注射方式 |
气管注射 |
|
感染部位 |
肺脏 |
|
病毒用量 |
1E+11VG,50μL |
新品来袭
目前,和元生物备好全新AAV血清型AAV-LungM3、AAV-LungX,全力保障您的肺部基因递送之旅;
未来,和元基于AAVneO®和AAVneO®Plus平台将继续筛选全新AAV血清型,扩大其应用领域。
此外,和元生物携手拥有10+年专业血管研究经验科研团队,重磅推出肺原代微血管内皮细胞血管生成实验服务,助您探究疾病与血管生成之间的密切关系
“整合你我资源,服务生命科学”,我们欢迎您的创新成果在和元生物落地,成为赋能更多研究者的创新工具产品。
如果您有高效精准靶向肺部基因递送的需求,欢迎咨询我们!
参考文献
[1] J Nanobiotechnology. 2022 Mar 3;20(1):101.doi: 10.1186/s12951-022-01307-x
[2] Hum Gene Ther. 2020 Sep;31(17-18):996-1009.doi: 10.1089/hum.2020.169
[3] BMC Biotechnol. 2017 May 15;17(1):43.doi: 10.1186/s12896-017-0365-2
[4] Stem Cell Res Ther. 2020 Oct 23;11(1):448.doi: 10.1186/s13287-020-01950-x
[5] Nat Commun. 2020 Aug 6;11(1):3929.doi: 10.1038/s41467-020-17577-8
[6] Nat Commun. 2021 Aug 2;12(1):4664.doi: 10.1038/s41467-021-25015-6
[7] Signal Transduct Target Ther. 2023 May 9;8(1):194.doi: 10.1038/s41392-023-01459-8
[8] Oxid Med Cell Longev. 2022 Jan 7;2022:9300269.doi: 10.1155/2022/9300269
[9] Cell. 2021 Feb 4;184(3):845-846.doi: 10.1016/j.cell.2021.01.020.
