制药生产过程微生物污染往往引发严重后果, 污染增加了操作员,公司和患者的风险,所有这些都可能导致严重的负面影响。 生物的污染会导致生产设施长时间关闭,以进行必要的调查,查明根本原因并防止再次发生,这将延缓关键性救生药物的生产和交付。
生物制药生产过程中,不论是中间体还是最终产品的取样对于生产至关重要。 除了通过生物负荷监测确保患者安全外,还需要进行取样以支持由全球监管趋势驱动的几个关键必要事项,包括过程分析技术(PAT)和设计源于质量(QbD)(图1)。
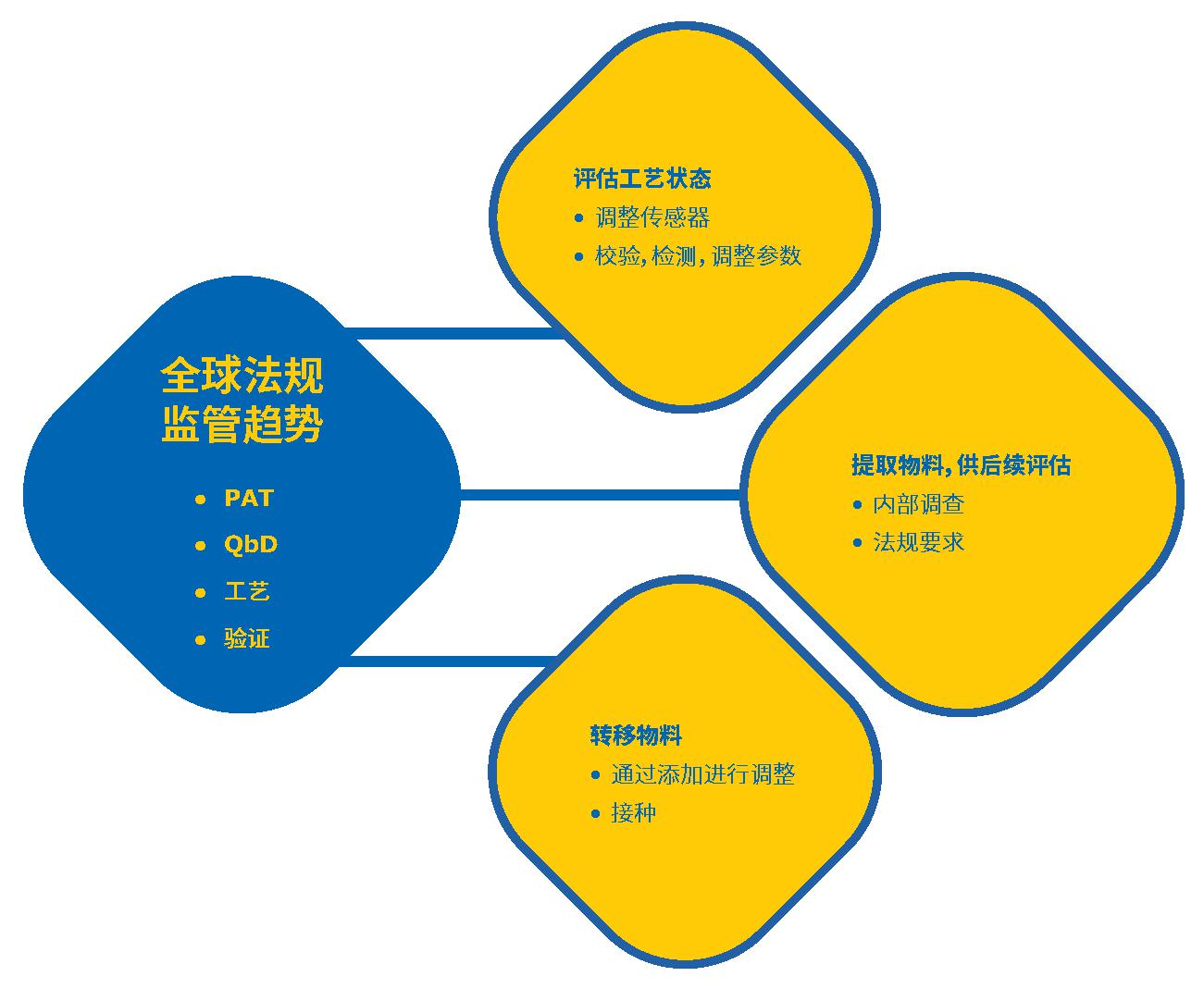
图1.药品生产工艺中取样的的关键驱动力。
传统取样方法的局限性和风险
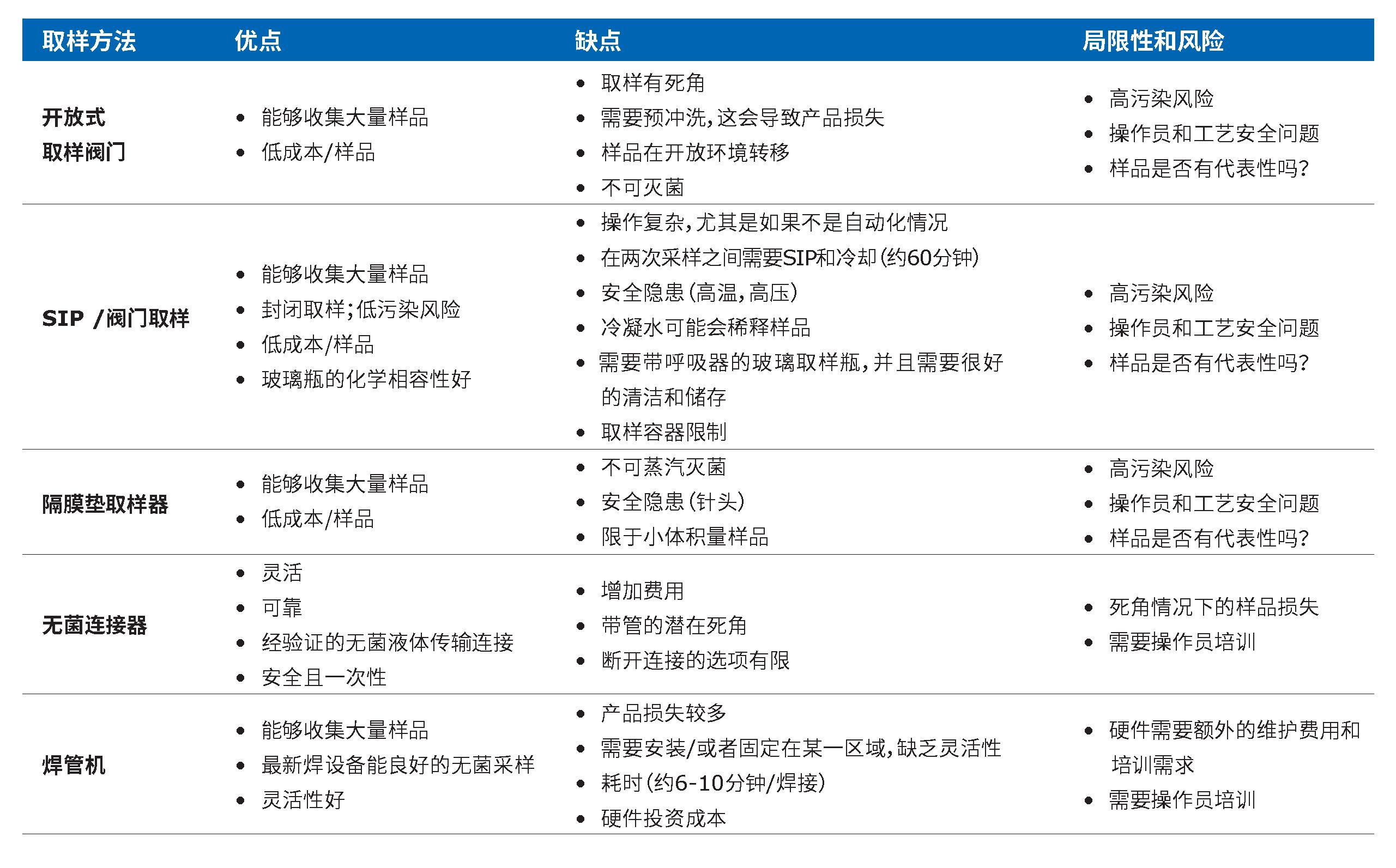
表2.与传统采样方法有关的优缺点摘要
封闭取样
鉴于传统采样的缺点,许多生物制药公司采用封闭的一次性采样技术也就不足为奇了。封闭式设计可确保将样品从样品点到分析点很好的隔离,从而在保持样品完整性的同时,降低了损失有价值产品的风险。
如图2所示,与传统方法相比,封闭的无菌过程采样具有多个优点,包括易用性,更好地符合法规要求和有限的投资。
表3总结了封闭式取样符合法规建议的具体方面,包括污染控制,操作员偏差的消除,收集代表性样品的能力以及健康和安全的焦点。

图2.与传统方法相比,一次性无菌取样具有明显优势。
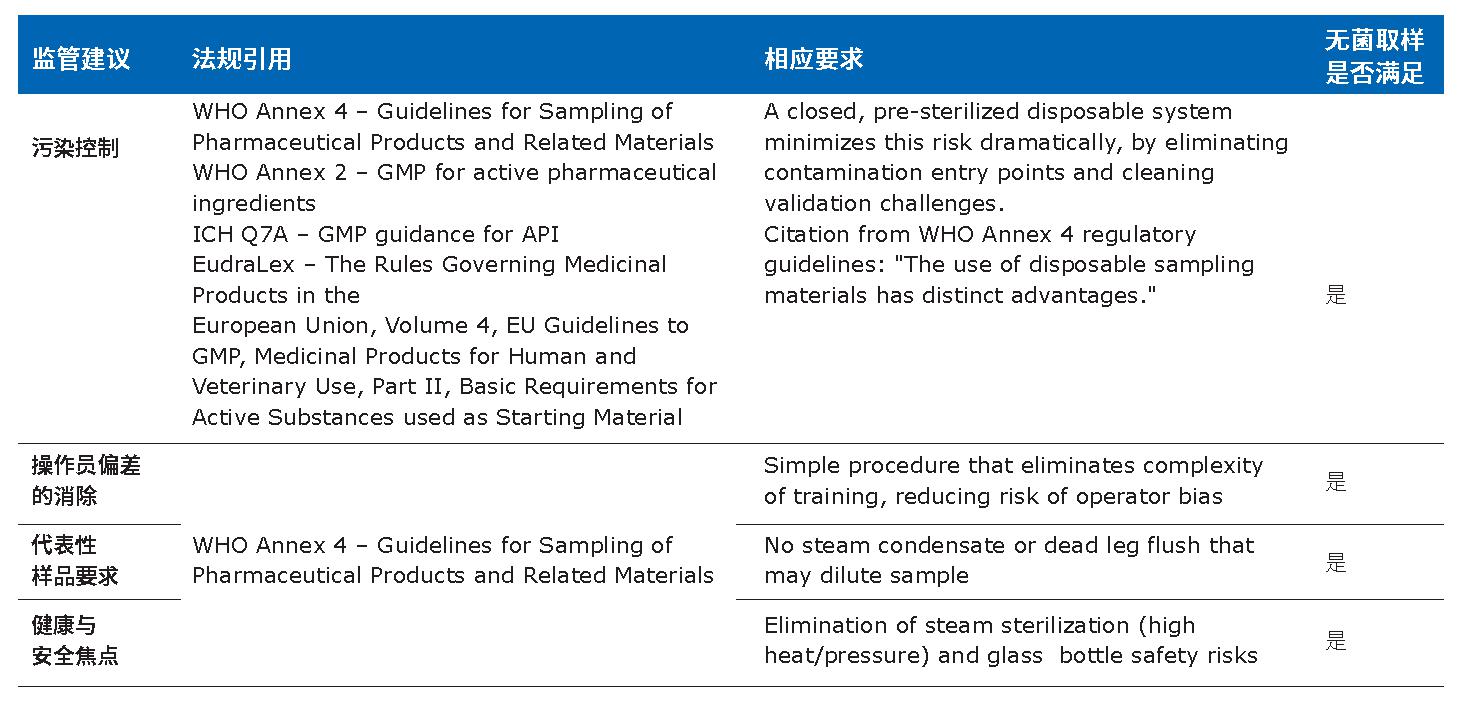
表3.无菌取样符合特定的法规要求。
无菌取样案例研究--病毒灭活的验证
此案例研究举例通过无菌取样用于病毒灭活验证,说明了封闭式取样的价值。一家生物制药公司,将病毒灭活作为细胞培养生产过程中的步骤,仅在验证过程中通过动力学来验证灭活。但是,FDA建议在验证和生产过程中都需执行灭活动力学。病毒灭活每五到十分钟最多需要15个样品,而使用传统CIP / SIP阀门和玻璃瓶进行取样则不可能完成。最终选择达到FDA的期望的解决方案,是基于封闭的60 mL PETG瓶以及将这些设备连接到罐子所需的合适的连接器,来实施无菌取样。除了满足法规要求外,药企获得的收益还包括质量控制(QC)实验室中更快,更准确的取样过程以及更轻松的样品处理。
总结
没有适当的采样,就无法监控生物制药生产过程。尽管存在许多取样选择,但并非所有方法都能很好地实现预期的收益或完全符合法规要求。选择一种稳健且优化的方法,并实施适当的取样计划可确保符合法规要求,并能更好地进行流程和取样管理。生物制药业界越来越认识到封闭式取样的价值,并利用许多优势来保护生产工艺,操作员以及最终患者。
NovaSeptum®GO™无菌取样
与SIP阀门/焊接等传统方法相比,NovaSeptum®GO™无菌取样系统的独特技术可缩短样品之间的周转时间,同时最大程度地减少产品损失和污染风险(表4)。集成的安全功能可通过在不使用设备时将其锁定并密封容器,从而在降低风险的策略上更加放心,确保样品安全并控制过程。

表4.无菌取样可以缩短样品之间的周转时间,同时最大程度地减少产品损失和污染风险。
参考文献
1. EU Guidelines to Good Manufacturing Practice: Medicinal Products for Human and Veterinary Use; Annex 1 Manufacture of Sterile Medicinal Products. http://www.gmp-compliance.org/guidemgr/files/ ANNEX%2001[2008].PDF
2. World Health Organization: Annex 4 WHO Guidelines for sampling of pharmaceutical products and related materials. http://apps.who.int/prequal/info_general/ documents/TRS929/WHO_TRS_929-Annex4.pdf
3. FDA Guidance for Industry: CGMP for Phase I Investigational Drugs. http:// www.fda.gov/downloads/drugs/ guidancecomplianceregulatoryinformation/ guidances/ucm070273.pdf
4. ICH Harmonised Tripartite Guideline: Good Manufacturing Practice Guide for Active Pharmaceutical Ingredients Q7. http://www.ich.org/ fileadmin/Public_Web_Site/ICH_Products/Guidelines/ Quality/Q7/Step4/Q7_Guideline.pdf
5. Suvarna, et al. Case Studies of Microbial Contamination in Biologic Product Manufacturing. American Pharmaceutical Review. Jan 1, 2011. http://www.americanpharmaceuticalreview.com/ Featured-Articles/36755-Case-Studies-of-Microbial-Contamination-in-Biologic-Product-Manufacturing/
如需下载白皮书:从法规监管视角看制药工艺中取样的风险缓解,以及了解更多NovaSeptum®GO™无菌取样,请点击此处(https://app.askform.cn/18480060001.aspx)。
如您正在研发新冠病毒药物,请点击此处(https://app.askform.cn/18374910001.aspx)填写问卷调查。我们会第一时间为您提供新冠药物开发所涉及的产品技术与服务组合,及全球专家的优先支持。帮助您快速到达临床,取得战“疫”的胜利。
新冠病毒药物研发默克联系人:
史秋明博士 客户技术应用总监
联系方式:miles.shi@merckgroup.com