作者:Nadia Tagnaouti1 , Anitha Thomas1 , Rebecca De Souza1 , Ian Backstorm1 , Andrew Brown1 , Eric Ouellet1 , Shyam Garg1 , Grace Tharmarajah1 , Keara Marshall1 , Shannon Chang1 , Timothy Leaver1 , Andre Wild1 , Oscar Seira2,3, Jie Liu2,3, Wolfram Tetzlaff2,3, Peter Deng4,5 , David J. Segal5 , Jan A. Nolta4 , Kyle D. Fink4 , R. James Taylor1 and Euan Ramsay1
1 Precision NanoSystems Inc., Vancouver, BC, Canada, 2 International Collaboration on Repair Discoveries (ICORD), 3 Department of Zoology, 4 Stem Cell Program and Institute for Regenerative Cures, University of California Davis Health Systems, Sacramento, CA, USA, 5 Genome Center, MIND Institute, and Biochemistry and Molecular Medicine, University of California, Davis, CA, USA
近年来,对一种能够在体内和体外传递有效载荷以调节基因表达的高效传递工具的需求一直在稳步增长。脂质纳米粒(LNPs)利用协同载脂蛋白E (apoE)的单剂量传递途径,通过低密度脂蛋白受体(LDLR)介导包裹核酸的有效传递。然而,它们从实验台到临床的应用都受到了相当大的限制,因为在制造过程中遇到了大大小小的挑战。在这里,我们通过描述脂质纳米颗粒的稳健制造和使用来弥补这一差距。我们使用优化的微流体平台,高效地将核酸(如siRNA、mRNA、质粒DNA)以适合管理的规模,在体外难以转染的细胞和动物模型中进行包装和递送。
在这里,我们提供了这些LNPs在初级皮质大鼠neu- rons中高效细胞摄取的证据,以及它们传递核酸有效载荷的能力,这些能力允许:通过siRNA介导的降解下调靶向mRNA,表达外源性mRNA序列,以及外源性表达克隆到质粒中的基因。这些LNPs能够达到高转化率的效率,没有可测量的相关毒性。我们还提供了初步的数据,详细说明了在纹状体注射后使用质粒DNA-LNPs在体内表达基因的效率
总的来说,这些研究为建立有效地将小(siRNA)和大核酸(mRNA,质粒DNA)传递给原始细胞用于治疗的策略提供了有价值的见解。在此基础上,我们通过优化LNP传递方法,为高效传递CRISPR-Cas9系统的导RNA和表达Cas9提供了一个合适的框架。
通过脂质纳米颗粒传递基因
脂质纳米粒(LNPs)是一个平台,可以用来传递核酸到细胞。LNPs模拟低密度脂蛋白(LDLs),由内源性途径摄取。LNPs对pH值敏感,其设计目的是将其有效载荷释放到细胞质中。
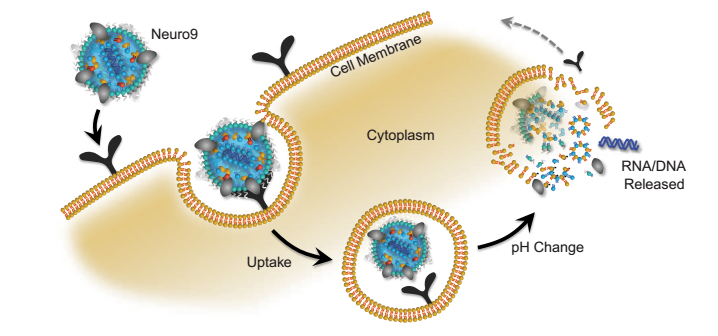
体外环境
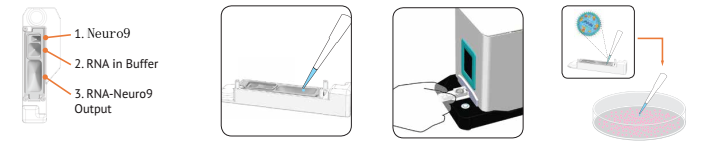
1.NanoAssemblrTMSpark反应器 2.吸取RNA和Neuro9溶液 3.插入Spark,点击“开始”4.吸出加到细胞里
体内环境

1.准备核酸溶液解冻Neuro9混合液 装入单独的注射器
2.把注射器放入NanoAssemblr Benchtop ,运行程序3min
3.用离心过滤或透析净化
4.直接注射或全身给药
Methods
1、原代大鼠皮层神经元培养
E18大鼠皮质组织购自BrainBits, LLC.,将皮质从运输介质中取出,用0.25%的色氨酸进行色氨酸染色trypsin-EDTA (ThermoFisher)。然后在DMEM (ThermoFisher)中用10%的FBS洗涤组织,使胰蛋白酶- eda失活,其次是DMEM。组织在神经介质(NeuroCult™Neuronal base Medium (StemCell))和NeuroCult™中研磨,SM1神经元补体(干细胞)和l -谷氨酰胺(干细胞)补充l -谷氨酸(Sigma),然后通过40μm细胞形成一个细胞悬液过滤器。然后将该悬浮液计数并镀在PDL涂层培养板或玻璃上,密度为4.8 x 104个细胞/平方厘米。每3-4天,一半的介质用不含L-谷氨酸的神经元介质更换一次。
2、LNPs治疗大鼠原代皮层神经元
7天后(DIV7) 5µg /ml的ApoE在指定剂量的LNP被添加。然后神经元孵育48小时后收获,进行终点评估。
3、流式细胞仪
用上述指定的LNP处理和孵育后,用PBS冲洗神经元,然后用0.25%的胰蛋白酶- edta色氨酸处理将它们从培养皿中分离出来。用3% FBS灭活PBS中的胰蛋白酶,使神经元失活
三聚体形成单细胞悬浮体然后用PBS将神经元球团洗净,再悬浮于悬浮液中加入缓冲液(BD biosciences)和碘丙钠(BD biosceinces)对凋亡细胞进行染色。悬浮的染色神经元然后通过35μm细胞过滤器,然后加入使用BDCelesta 流式细胞分析仪。
4、可行性分析
根据制造商的说明,PrestoBlue®细胞活性试剂(ThermoFisher)中包含的标准协议,值被校准到含有不含神经元介质的介质管中。
5、免疫细胞化学
在此评估中,将神经元置于涂有PDL涂层的盖玻片上,然后进行培养、处理和孵育,用PBS洗涤,4% PFA固定神经元,用0.1% trton - x对神经元进行渗透,然后用NDS阻断,然后用MAP2抗体(Sigma M4403)孵育1小时。然后在NGS中阻断神经元,然后进行孵育与GFP抗体(AbCam ab13970)在NGS过夜。然后加入二级抗体,AlexaFluor-594用于MAP2和alexafluor GFP - 488。盖玻片安装在玻璃载玻片上使用extended®钻石防褪色贴片(Thermofisher),在共焦显微镜上成像。通过实验证实了第一和第二抗体的选择性结合没有主控件(数据未显示)
6、RNA提取和RT-qPCR
在对神经元进行处理和孵育后,使用PureLink®RNA Mini Kit RNA提取试剂盒预成型RNA提取(hermoFishe)按照制造商的说明。使用NanoDrop (ThermoFisher)进行RNA浓度测定和然后使用相同数量的RNA进行cDNA转换,使用 SuperScript IV VILO Master Mix (ThermoFisher) 说明书指导。采用TaqMan引物和探针对目标mRNA和从IDT获得ActB进行RT-qPCR, iTaq Universal Probes Supermix master mix (BioRad),在BioRad CFX96运行热循环(BioRad),每个PCR三个重复。使用∆∆Ct方法将靶mRNA的表达值归一化为ActB值。
mRNA在大鼠原代神经元中的传递
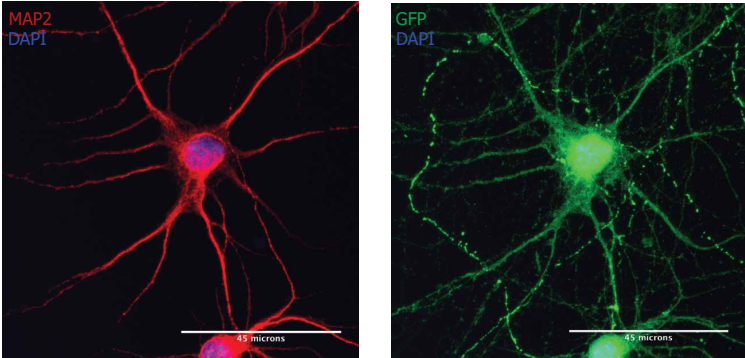
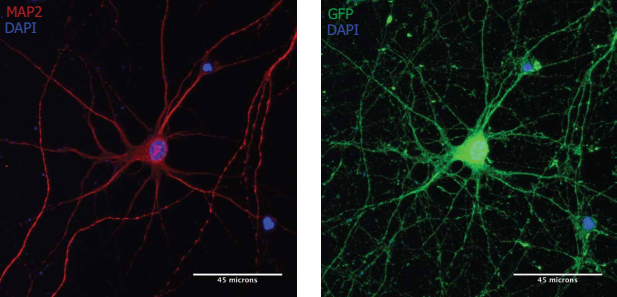
注:MAP2阳性神经元(红色)经Neuro9 GFP mRNA-LNP 5µg /毫升ApoE的处理后表达GFP(绿色).胞用抗map2一抗/alexa fluor-594偶联二抗和抗GFP一抗/alexa fluor-488偶联二抗染色.核用DAPI染色(蓝色)
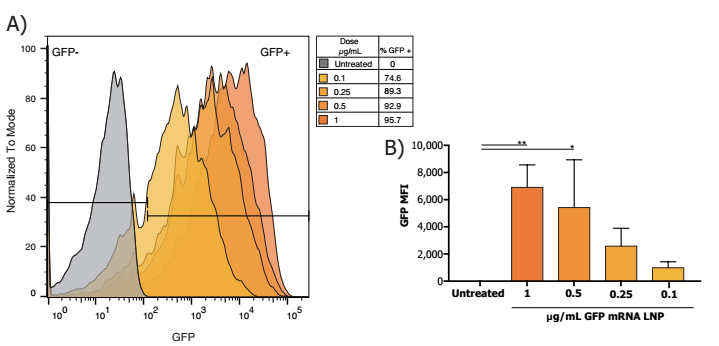
大鼠原代神经元在5µg /mLApoE存在的情况下经过Neuro9 GFP mRNA-LNP处理48 h后,流式细胞仪分析DIV 7,显示> 95%的神经元吸收了LNP(计算使用纳米颗粒内的荧光探针并encorporated)即使在不同的治疗剂量的GFP mRNA LNP使用(数据没有显示)。
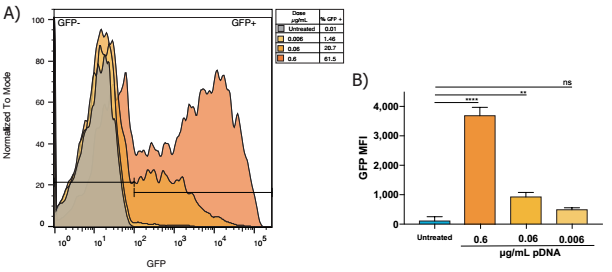
- 的百分比GFP+神经元呈剂量依赖性,其中1 ug/mL的比例最高。
- 平均荧光强度(MFI)最高的GFP mRNA剂量1µg / mL,每个处理n = 3,单向方差分析与Dunnett多个比较测试,* * p < 0.005, p < 0.05
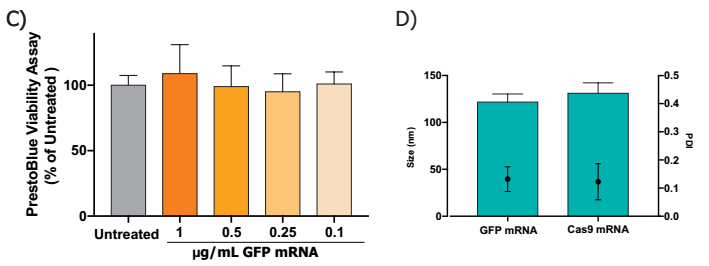
- 使用PrestoBlue®细胞活力试剂检测细胞活力。在使用任何剂量时均未观察到毒性,n=6为每个治疗的单因素方差分析(Dunnett’s multiple)比较测试
- 封装不同mRNA的纳米颗粒的尺寸和多分散性指数(PDI)具有可比性。GFP mRNA全长996个核苷酸,Cas9 mRNA全长4479个核苷酸长度。尽管使用不同长度的mRNA,但粒径和PDI没有显著差异,学生测试
质粒在大鼠原代神经元中的传递
MAP2阳性神经元(红色)经Neuro9 GFP处理后表达GFP(绿色)plasmid-LNP 5µg /毫升ApoE的存在,细胞用抗map2一抗/alexa fluor-594偶联二抗和抗gfp一抗/alexa fluor-488偶联二抗染色,核用DAPI染色(蓝色)
流式细胞仪分析在Neuro9 GFP plasmid-LNP存在下治疗48 h后的情况5µg /毫升ApoE在鼠初级神经元,DIV 7,显示> 95%的神经元表现出lnp的吸收(用荧光探针计算,纳米颗粒内确实有包裹)用不同剂量的GFP质粒处理(数据未显示)
- GFP neruons呈剂量依赖性,其中0.6ug/mL的比例最高。
- 在GFP MFI中也观察到这种剂量反应模式,n=3表示每次治疗的单因素方差分析Dunnett's多重比较检验,**** p<0.0001, ** p<0.005
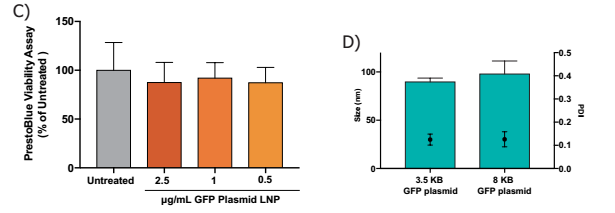
- 使用PrestoBlue®细胞活力试剂检测细胞活力。任何剂量均未观察到毒性,每次治疗n=6,单因素方差分析与Dunnett’s倍数比较测试
- 包覆不同质粒的纳米颗粒大小和PDI具有可比性。尽管使用不同大小的质粒,颗粒大小和PDI没有显著差异,学生的t-test
质粒在体内的传递
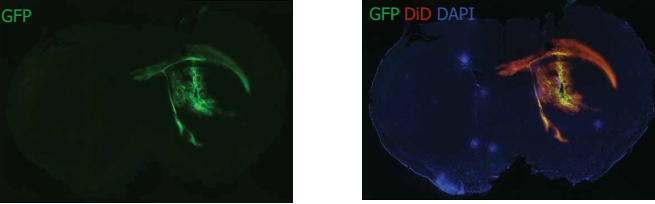
10个月大的FVB小鼠,皮下注射GFP plasmid-LNP,48H后GFP表达(绿色)。注入5μl 3mg/ml GFP plasmid-LNP。用DAPI染色(蓝色)细胞核,用DiD染色(红色)的LNP,GFP表达(绿色)在相同的区域上。LNP的摄取和GFP的表达均在注射区域内定位纹状体,并已扩散到包括心室部分在内的周围增生性区域系统和胼胝体。
小RNA在大鼠原代神经元中的传递
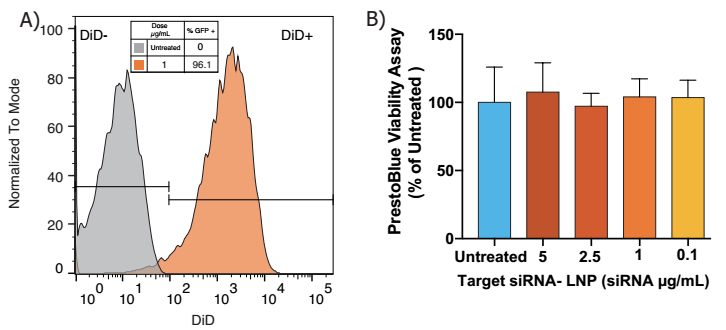
A)使用Neuro9 siRNA-LNP处理48 h后流式细胞术分析,5µg /毫升ApoE存在鼠主要神经元中,DIV 7,显示> 95%的神经元显示吸收的脂质纳米颗粒(使用荧光探针计算纳米颗粒内的包壳)
B)使用PrestoBlue®细胞活力试剂检测细胞活力。在有效剂量为5倍的情况下,未观察到毒性,采用单因素方差分析和 Dunnett’s 多重比较试验。
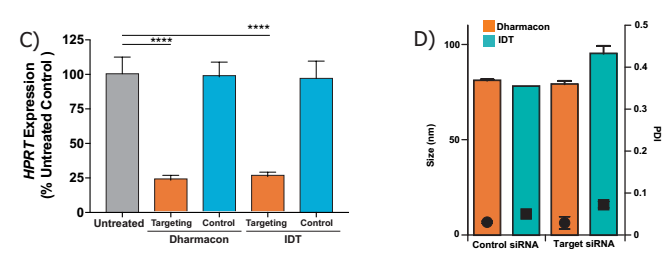
C) siRNA LNP剂量在1µg /ml的产品,同时使用IDT和Dharmacon的siRNAs,靶向mRNA75%击倒,每个处理n=3,与Dunnett的单因素方差分析多重比较检验,**** p<0.0005。
D) C) 封装不同siRNA的纳米颗粒的大小和PDI 比较,尽管使用不同大小的siRNAs,但颗粒大小和PDI没有显著差异。
结论
- NanoAssembly™平台能够创建携带siRNA、mRNA或质粒有效载体高度可重现性的LNPs
- 这些LNPs在原代、大鼠、皮层神经元可以有效地传递(>95%),并且允许相关的payloads高效传递
- 即使在高剂量时,LNPs对这些初级神经元也没有毒性(50x)
我们的研究结果证实,这些脂质纳米粒可以作为一种CRISPR-Cas9组分到介导基因的有效的传递系统使用
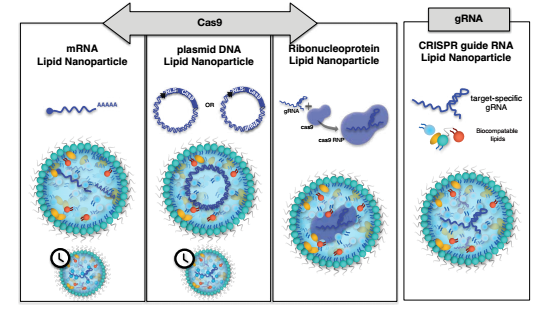
LNP-mediated CRISPR-Cas9传递
LNPs具有多种功能,可以通过mRNA、pDNA或预先形成的核糖体蛋白复合物来传递Cas,一个或多个导向股也可以很好传递
实验仪器:
NanoAssemblrTMSpark纳米颗粒合成系统 (点击此处打开产品链接)

NanoAssemblr Benchtop纳米颗粒合成系统 (点击此处打开产品链接)

