实时荧光定量PCR技术是在普通PCR反应体系中加入荧光试剂,利用荧光信号实时检测PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。实时荧光定量PCR能够专一、灵敏、快速、高重复性地精确定量起始模板浓度。tRF & tiRNA是由tRNA切割产生,长度约15-45个核苷酸的小RNA。由于tRF & tiRNA长度太短,且与tRNA序列完全重叠,不能通过传统的实时定量PCR进行检测。本公司通过在tRF & tiRNA两端引入人工合成序列(adaptor),设计特殊的跨连接位点的定量PCR引物,可以精确检测微量样品中tRF & tiRNA表达水平。
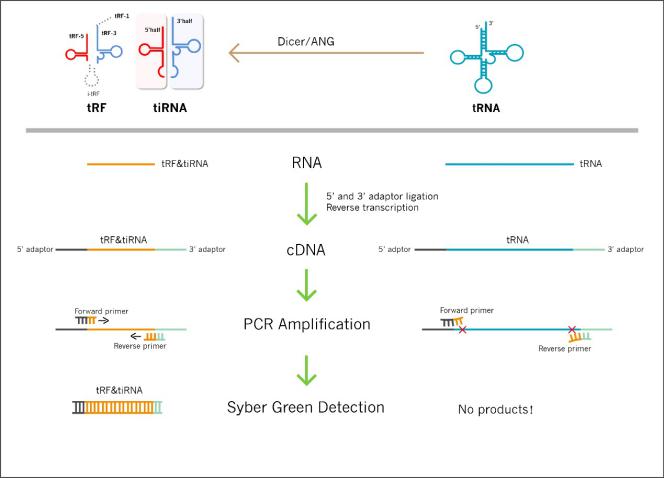
图1. 双端接头法保证了tRF & tiRNA PCR产物的高特异性。
康成生物tRF & tiRNA实时定量PCR技术服务流程
1. 引物设计、合成
设计并合成目的tRF & tiRNA的特异性PCR引物。
2. 样品RNA抽提
a. 若实验对象为组织样品,取适量(50-100mg)新鲜组织样品或正确保存的组织样品,加1ml的RNA抽提试剂Trizol(Invitrogen),匀浆后抽提RNA。
b. 若实验对象为细胞样品,每份样品取1×106~1×107细胞,完全吸去培养液后加1ml的RNA抽提试剂Trizol(Invitrogen),裂解后抽提RNA。
3. RNA质量检测
a.紫外吸收测定法测定RNA在波长260nm和280nm的吸收值,获得RNA的浓度并通过A260/280及A260/230的吸收比值判断RNA的纯度。
b.甲醛变性琼脂糖凝胶电泳检测RNA纯度和完整性。
注:用于tRF & tiRNA实时定量PCR检测的RNA样品,必须高纯度、完整,没有RNase 污染(降解的样品不能用于实时定量PCR检测),同时提取方法必须保证所得样品包含完整的小RNA部分。
4.RNA预处理(可选)
使用rtStar™ tRF&tiRNA Pretreatment Kit (Cat# AS-FS-005, Arraystar)进行预处理,去除3’氨酰基末端与3‘环磷酸末端,磷酸化5’羟基末端,并移去m1A, m3C等多种甲基化修饰。
注:tRNA上存在大量的转录后修饰,而且tRNA需与氨基酸形成氨酰基tRNA方可参与蛋白翻译。当tRNAs被切割为tRFs&tiRNAs时,这些修饰(包括甲基化修饰、氨酰基末端修饰)会全部或部分的保留下来。tiRNAs常由RNA内切酶Angiogenin切割产生,这类内切酶会在切割位点产生5‘羟基(5’-OH)末端与3’环磷酸(3‘-cP)末端。然而,5’端与3‘端的接头连接步骤,需要底物小RNA 5’端为磷酸,3‘端为羟基。此外,某些tRFs&tiRNAs的内部修饰比如m1A, m1G与m3C会严重阻碍反转录过程。因此为了准确检测tRFs&tiRNAs,这些修饰必须被有效的去除。
4. 逆转录合成cDNA
使用rtStar™ First-Strand cDNA Synthesis Kit (3’ and 5’ adaptor) (Cat# AS-FS-003, Arraystar) 试剂盒进行接头连接和反转,合成cDNA第一链。
5. 实时定量PCR
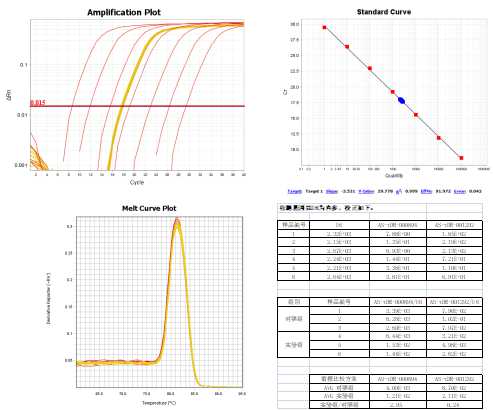
以合成的cDNA作为模板进行实时定量PCR扩增,梯度稀释的标准同时进行实时定量PCR扩增,根据Ct值制备标准曲线。以同样的方法测定每个样品中的内参,校正上样误差。
6. 分析结果、提供实验报告
分析实时定量PCR结果,根据标准曲线定量样品中的目的tRF & tiRNA。提供实验报告,包括详细的实验方法,实时定量PCR实验数据和图表。