肝细胞癌 (HCC) 是最常见的肝癌类型,非酒精性脂肪性肝炎(NASH)在内的多种致病因素均可促进肝癌的发生发展,但到目前为止,肝癌的治疗手段十分有限。最近报道表明,膳食胆固醇或从头合成的胆固醇可通过合成胆汁酸(BAs)促进HCC发生。线粒体胆固醇主要通过甾体合成急性调节蛋白1(STARD1)进行调控,但其对HCC发展的作用尚不清楚。巴塞罗那生物医学研究所Jose C. Fernandez-Checa研究团队研究报道了STARD1刺激胆汁酸产生,进而促进NASH向HCC发展。相关成果发表于《Journal of Hepatology》。

NASH 驱动的HCC患者STARD1 表达增加和胆汁酸(BA)水平异常
尽管肝脏中STARD1基础表达较低,但在NASH患者中STARD1表达上调,而在单纯脂肪变性的受试者中无变化。STARD1在NASH驱动的HCC患者中尚未被探讨,基于此,该研究对NASH驱动的HCC患者STARD1的表达进行检测分析。结果显示,与对照组相比,NASH驱动的HCC患者肝脏中STAR基因转录水平和STARD1蛋白水平增加。肝切片免疫组化显示STARD1染色增强,且肝脏游离胆固醇水平升高。
此外,肝癌样本中HMGCS、HMGCR和SREBP2(胆固醇稳态的主要转录因子)表达增加。尽管SREBP2受到胆固醇负反馈调控,但本研究探讨了胆固醇升高同时伴随 SREBP2 激活与TNFR1-Caspase-2-S1P-SREBP2 轴触发的难治性反馈回路有关。qPCR结果显示HCC患者CASP-2和MBPTS1 (S1P)表达增加,同时HIF1A和靶基因(PDK1、SLC2A1(Glut 1)、SLC2A3(Glut 3)和 SLC25A11(2-OGC))表达增加,这些基因可以调节HCC中线粒体GSH稳态。
接下来本研究检测了HCC患者肝脏BA水平。与对照组相比,HCC患者肝脏总BA水平增加2倍,这与CYP7A1、CYP8B1、CYP27A1、CYP7B1、CYP7A1、CYP27A1表达增加一致,这表明BA合成的经典和替代途径被激活。
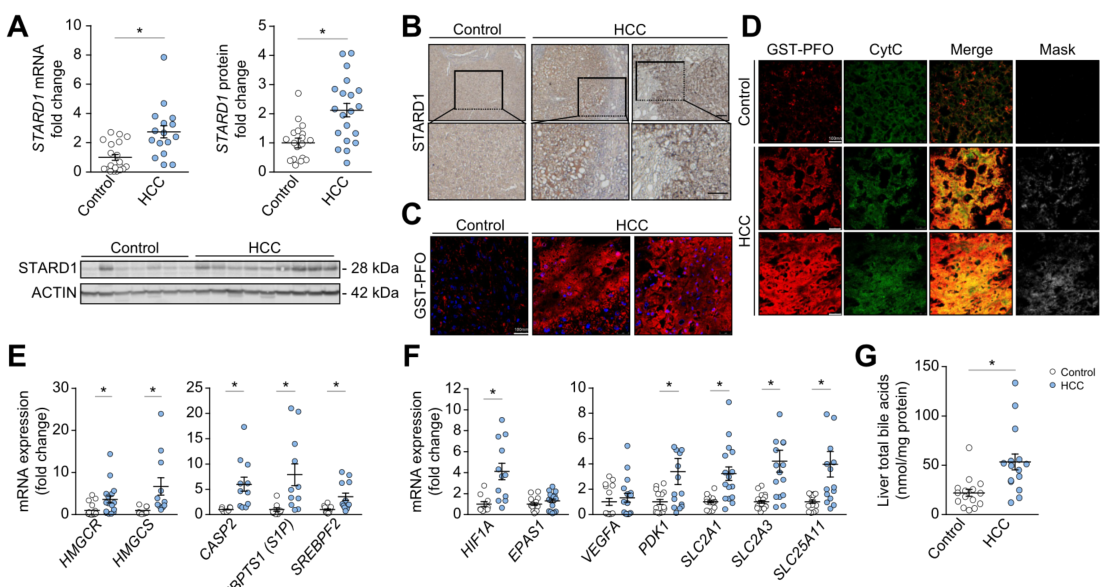
图1. NASH驱动的HCC患者STARD1表达增加
胆固醇促进NASH驱动的HCC小鼠疾病进展并诱导STARD1表达
尽管越来越多的证据表明胆固醇与HCC发展有关,但也有研究表明胆固醇在HCC中具有抑制肿瘤作用。鉴于单独高脂饮食(HFD)不会诱导NASH以及二乙基亚硝胺 (DEN) 联合HFD 喂养不能完全模拟NASH 驱动的HCC,本研究通过补充胆固醇的HFD饮食(HFHC)联合DEN预处理建立饮食 NASH 驱动的HCC小鼠模型。这种饮食已被证明会诱发NASH。实验结果表明与DEN+HFD小鼠相比,DEN+HFHC小鼠血清丙氨酸氨基转移酶 (ALT) 水平更高,同时肝脏胆固醇含量增加和Hmgcr表达降低。脂肪变性程度和TG水平在DEN+HFD和DEN+HFHC小鼠之间相似,但与DEN+HFD小鼠相比,DEN+HFHC小鼠肝纤维化更为严重。
此外,DEN+HFHC小鼠肝脏切片显示游离胆固醇水平升高,线粒体中也存在游离胆固醇。Tnfa 和 Ccl2表达升高表明,DEN+HFHC组肝脏炎症增加。重要的是,喂养24周后DEN+HFD 小鼠出现肿瘤变化,但DEN+HFHC小鼠肿瘤数量和最大面积变化更大,喂养32周后肿瘤数量和最大面积进一步增加。肿瘤负荷增加了血清Afp水平,尤其是在DEN+HFHC组,并且这Afp和Yap(HCC标记物)表达升高。同时DEN+HFHC诱导肝脏Stard1表达,Stard1在HCC肿瘤中优先表达。与DEN+HFD小鼠相比,DEN+HFHC小鼠中与肿瘤发生(Gpc3、Ly6d和Golm1)、细胞粘附和相互作用(Birc5、Cd44和Lyve1)以及细胞增殖(Mki67)相关的标记物表达增加。
为了进一步确定胆固醇在NASH驱动HCC中的作用,本研究采用Ezetimibe(EZE)进行干预,EZE可阻止肠道吸收胆固醇,尽管其在临床NASH中的作用尚不明确,但其在DEN+HFHC驱动的HCC中干预效果已被证实。EZE干预DEN+HFHC小鼠模型后,肝脏胆固醇、相关基因表达水平(Hmgcr 和 Hmgcs1)、肝纤维化程度等等均得到改善。由此进一步说明,膳食胆固醇可以促进NASH驱动HCC的发展。
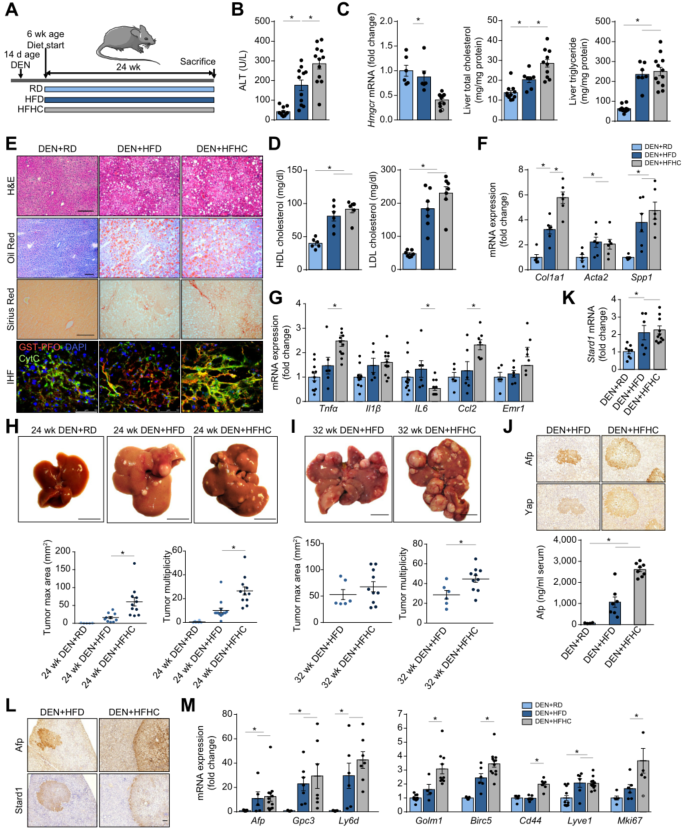
图 2. HFHC喂养促进DEN处理的野生型小鼠NASH驱动的HCC发展
肝细胞STARD1 缺失可减弱NASH驱动的HCC
为了探讨STARD1在NASH驱动HCC中的作用,本研究构建了肝脏特异Stard1敲除小鼠(Stard1△Hep)评价NASH驱动HCC的易感性。MUP-uPA小鼠肝细胞中STARD1缺失,该动物是一种内源性慢性内质网应激模型,其特征是尿激酶纤溶酶原激活剂(uPA)表达,通过内质网应激和过度喂养协同作用发展为肝癌。将MUP-uPA小鼠与Stard1△Hep小鼠杂交繁育MUP-uPA-Stard1△Hep小鼠并采用HFHC饮食。与MUP-uPA-Stard1f/f小鼠相比,MUP-uPA-Stard1△Hep小鼠表现出肝脏Stard1表达显著降低。HFHC饮食喂养MUP-uPA-Stard1f/f小鼠26周会导致肝脏肿瘤发展,但MUP-uPA-Stard1△Hep小鼠肿瘤数量和最大面积显著减少。同时血清Afp水平降低和参与纤维化(Col1a1和Acta2)和炎症(Il6和Il1b)的基因表达降低,以及肿瘤标记物(Afp、Cd44和Ly6d)水平降低。有趣的是, Stard1敲除并不影响MUP-uPA-STARD1△Hep小鼠内质网应激标记物的表达,表明在NASH驱动的HCC模型中,Stard1缺失的抑癌作用与内质网应激无关。
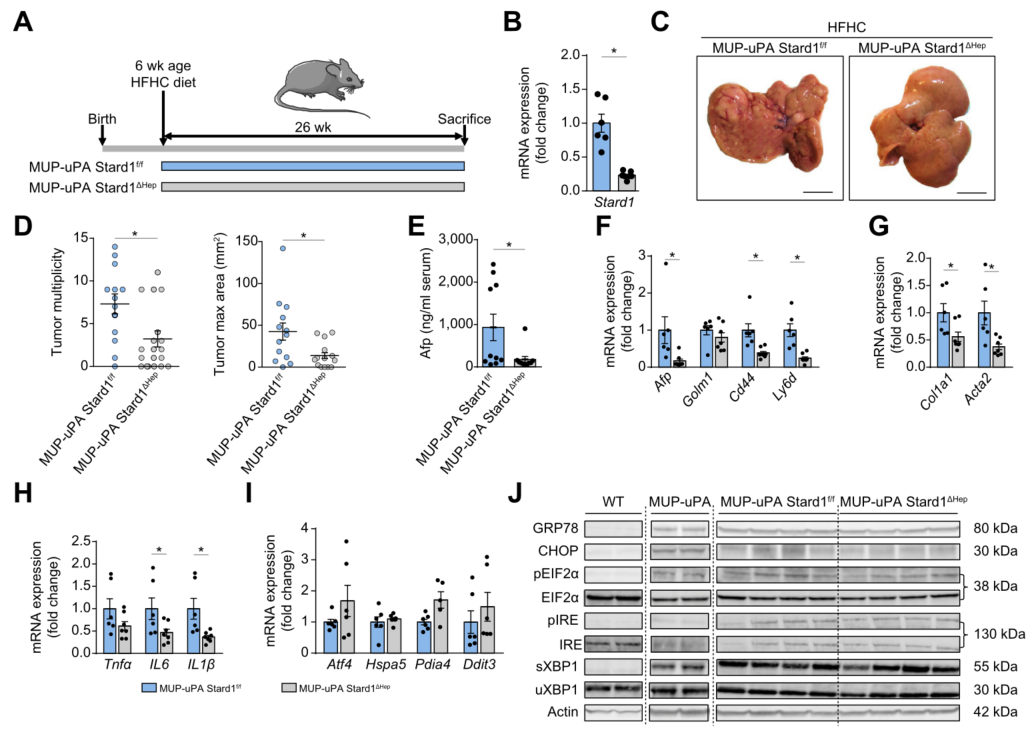
图3. MUP-uPA小鼠肝细胞Stard1缺失减弱了小鼠中NASH驱动的HCC
此外,对Stard1△Hep小鼠进行DEN干预,然后进行HFHC饮食24周。与MUP-uPA模型相似,DEN处理的Stard1△Hep小鼠对HFHC介导的HCC发展具有相对抵抗力,表现出肿瘤多样性和最大面积的降低、血清Afp水平降低。Stard1△Hep小鼠肿瘤Yap和Afp表达降低和肿瘤标记物mRNA水平降低,而炎症相关基因没有变化。在DEN+HFHC处理的Stard1△Hep小鼠中内质网应激标记物表达不变。因此,这些结果说明STARD1在NASH驱动HCC中独立于内质网应激的关键作用。
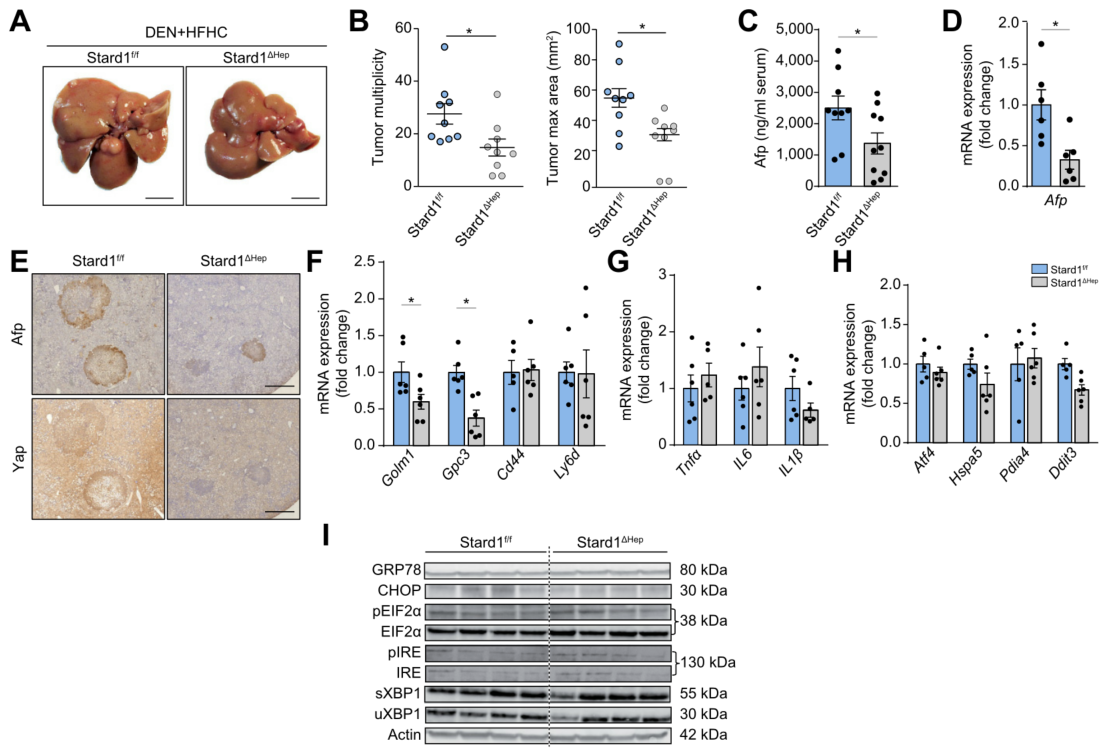
图 4. Stard1△Hep小鼠对DEN+HFHC诱导的HCC不太敏感
STARD1过表达加剧DEN+HFHC饮食驱动的 HCC
为了进一步确证STARD1在NASH驱动HCC中的作用,在DEN+HFHC野生小鼠处死前5周注射携带Stard1 cDNA腺病毒来过表达Stard1(AD-Stard1)。与注射空白对照载体小鼠(AD-对照)相比,AD-Stard1组肝脏Stard1表达(mRNA和蛋白水平)增加15倍。这一结果增强了DEN+HFHC肝脏肿瘤多样性。在AD-Stard1组中,HCC标志物(Afp、Yap)在肿瘤中的表达程度更高。此外,肿瘤标志物(Afp、Yap、Golm1 或 Krt19)表达、炎症相关和缺氧调节基因表达增强。AD-Stard1肝脏氧化应激显著高于AD-对照组。STARD1促肿瘤作用需要饮食中添加胆固醇(HC),在DEN+常规饮食喂养的小鼠或单独喂养HC 24周的小鼠中,STARD1过表达不会导致HCC发生。总的来说,STARD1和膳食胆固醇协同促进HCC发展。
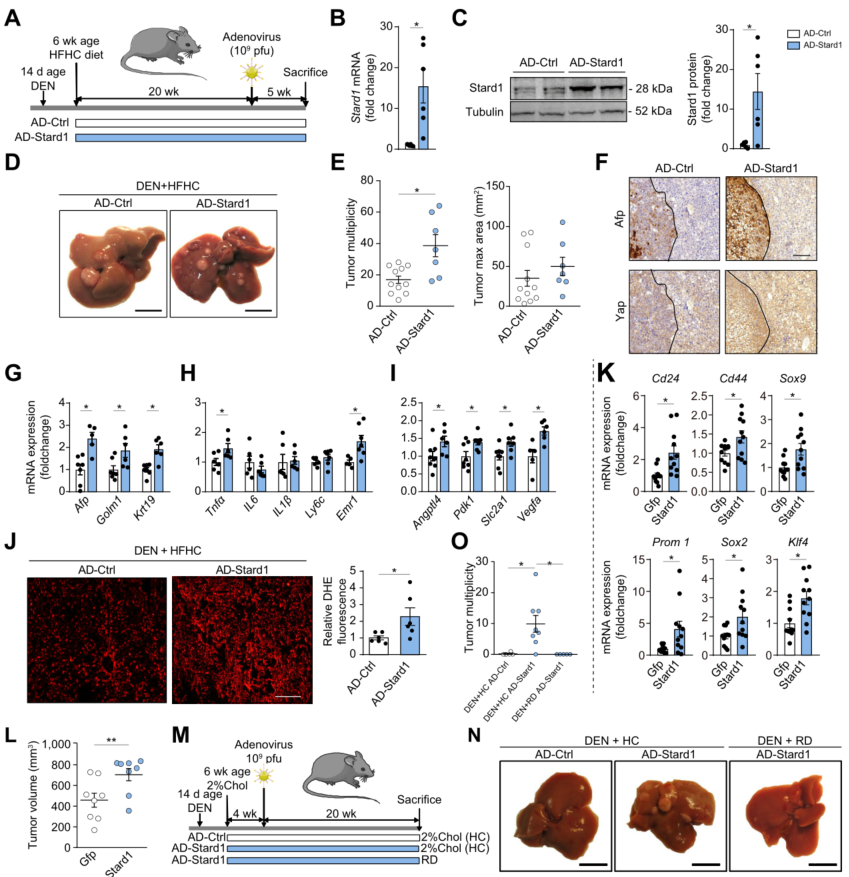
图5. Stard1过表达增加DEN+HFHC驱动的HCC
STARD1调节BA水平
鉴于BAs与NASH进展和HCC发展有关,本研究对STARD1是否调节NASH驱动HCC中肝脏BAs水平进行研究。对AD-Stard1和Stard1△Hep小鼠肝脏BAs进行质谱分析。实验结果表明与AD对照组小鼠相比,AD-Stard1小鼠肝脏中BA总含量增加,如βMCA和CA及其牛磺结合衍生物Tα/βMCA和TCA水平增加,其水平比去氧胆酸(TUDCA)、牛磺去氧胆酸(TCDCA))高1个数量级。与Stard1f/fmice相比,Stard1△Hep小鼠总肝BA水平显著降低,TCA、bMCA和CA水平较低。与MUP-uPA-Stardf/f小鼠相比,在MUP-uPA-Stard1△Hep小鼠中观察到类似的βMCA、Tα/βMCs和TCA水平降低。但在AD-Stard1或Stard1△Hep小鼠中,替代途径中BA合成的中间产物氧化甾醇24S-羟基胆固醇(24S-OH-Chol)和27-羟基胆固醇(27-OH-Chol)水平没有变化。有趣的是,AD-Stard1小鼠 Cyp7a1、Cyp8b1、Cyp27a1和Cyp7b1以及STARD1△Hep小鼠Cyp27a1和Cyp7a1的表达保持不变。此外,Stard1过表达的AD-Stard1小鼠中FXR (Nr1h4)以及Nr0b2和Abcd11表达降低(50-60%),但Nr1h4及其靶基因 Nr0b2、Abcb11和Abcb4在DEN+HFHC Stard1△Hep小鼠与 DEN+HFHC Stard1f/f小鼠中无差异,表明Stard1在BA合成和HCC发展中的调节作用与FXR无关。这些结果表明,HCC发展过程中肝BAs中很大一部分受STARD1调控。
BAs诱导参与自我更新、干性和炎症基因的表达
为探讨STARD1介导的BAs调控与HCC之间的关系,本研究检测了STARD1调控BAs对参与自我更新和多能性的转录因子表达的影响,这些转录因子与HCC发病机制有关。TIC (CD133+/CD49f+)从 HCC小鼠模型分离出来,并显示出具有致癌活性和致瘤性。用CA、TCA和βMCA联合治疗TICs,其浓度模拟AD-Stard1小鼠中观察到的水平,结果显示胆汁酸增加Yamanaka转录因子Sox2和Pouf51、干细胞标记物Nanog和Cd24、炎症因子Ccl2和Cxcl1的表达。有趣的是,成熟肝脏中多能干细胞和早期分化基因的表达水平与胎肝和诱导多能干细胞(iPSC)衍生的肝细胞样细胞相似。与先前研究结果一致,原代小鼠肝细胞(PMH)与CA、TCA和βMCA孵育Sox2、Myc、Klf4和Pouf51表达、干细胞相关和癌症干细胞标记物Cd24、Cd44、Sox9和Nanog以及炎症基因Ccl2和Cxcl2的表达显著增加。尽管CDCA和次级BAs(DCA和LCA)对TIC具有细胞毒性,但较低浓度(10 uM)BAs可诱导参与自我更新、干细胞和炎症的基因表达。
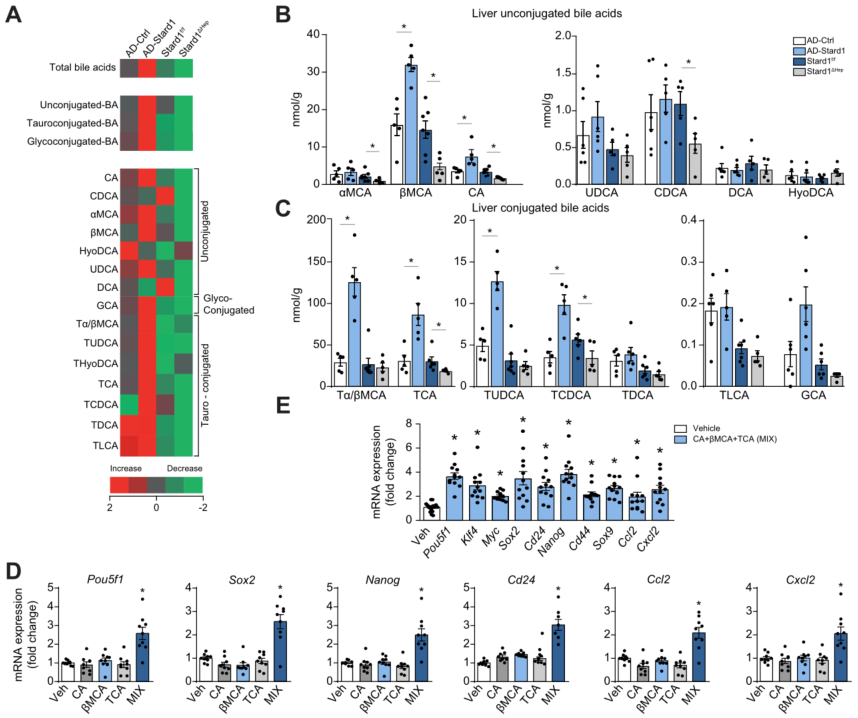
图6. NASH-HCC模型中BAs的分子种类及其对自我更新、干性和炎症相关基因表达的影响
小结
NASH驱动HCC发展是一个日益增长的公共卫生负担,且发病率将进一步增加(与肥胖、糖尿病有关),由于对HCC发病机制认识不足,其有效治疗受到限制。本研究揭示NASH驱使HCC的新机制,阐明了类固醇生成急性调节蛋白1(STARD1)在NASH驱动HCC中的关键作用,STARD1通过调控线粒体替代途径中BAs的生成,刺激肝细胞多能性、自我更新以及炎症进而促进NASH驱动HCC发生发展。本研究为肝癌的预防和治疗提供了一定理论基础和潜在靶点。
参考文献
Laura Conde de la Rosa, et al. STARD1 promotes NASH-driven HCC by sustaining the generation of bile acids through the alternative mitochondrial pathway. Journal of Hepatology.2021.https://doi.org/10.1016/j.jhep.2021.01.028.
原文阅读,请长按识别下方二维码

精彩推荐
3. Cell Metabolism | 肠道菌群相关代谢物--胆汁酸生物学功能
4. Cell Metabolism | 靶向肝脏GLS1可改善非酒精性脂肪肝
7. 客户案例︱高脂饮食大鼠肝脏、血清和盲肠胆汁酸的变化对肝脏脂肪变性的影响


