
期刊:MedComm (2020)
影响因子:9.9
伯豪产品服务:mRNA-seq
导读
在类风湿关节炎(RA)的发病机制中,炎症巨噬细胞的表观遗传调控控制炎症的发生和消退。然而,巨噬细胞介导的关节炎损伤的机制在很大程度上仍然不清楚。本研究发现,在RA患者和实验性关节炎小鼠中,滑膜组织中赖氨酸乙酰转移酶2A (KAT2A)的表达增加与炎症性关节免疫病理密切相关。MB-3 (KAT2A特异性化学抑制剂)可显著改善胶原诱导关节炎模型中的滑膜炎和骨破坏。药理抑制和siRNA沉默KAT2A不仅抑制了先天刺激触发的促炎基因(如Il1b和Nlrp3)的转录,而且在体内和体外也破坏了Nlrp3炎性体的激活。机制上,KAT2A通过抑制NRF2活性及下游抗氧化分子促进巨噬细胞糖酵解重编程,支持H3K9ac,限制NRF2介导的促炎基因转录抑制。靶向KAT2A代表了RA和相关炎性疾病患者的潜在治疗方法。
研究技术
mRNA-seq
技术路线图
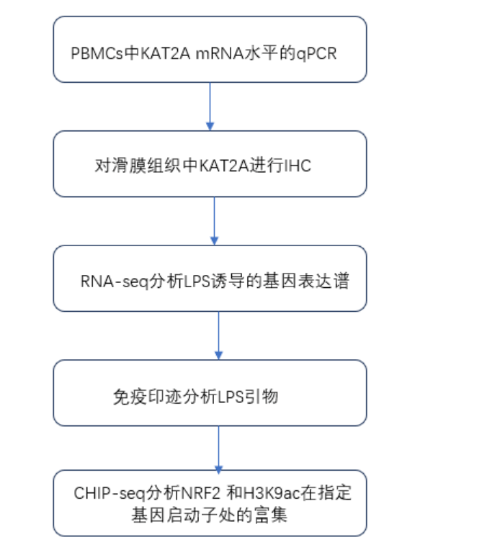
研究结果
1. 在人和小鼠中,KAT2A表达的增加与关节炎症有关
收集了健康对照、稳定型RA (SRA)患者、活动性RA (ARA)患者的PBMC样本,并分析了KAT2AmRNA的表达情况。RA患者,尤其是ARA患者的KAT2A mRNA水平显著高于健康对照。KAT2A mRNA水平较高的RA患者,IL1B的表达水平也相应较高。通过免疫组化(IHC)进一步分析骨关节炎(OA)和RA样本滑膜组织中KAT2A的表达,直接证实了RA患者炎症膝关节中KAT2A表达升高。
接下来建立了CIA模以评估小鼠滑膜组织中KAT2A表达的变化。随着关节炎的进展,CIA模型滑膜组织样品中KAT2A mRNA和蛋白的表达均显著升高,与人类RA患者的现象一致。关节炎诱导后CIA模型滑膜巨噬细胞中KAT2A的mRNA表达明显增高。此外,KAT2A的表达与关节炎小鼠滑膜巨噬细胞中Il1b的表达和临床评分有很强的相关性。这些数据表明,无论是在RA患者还是小鼠CIA模型中,KAT2A的表达都与关节炎症呈正相关。
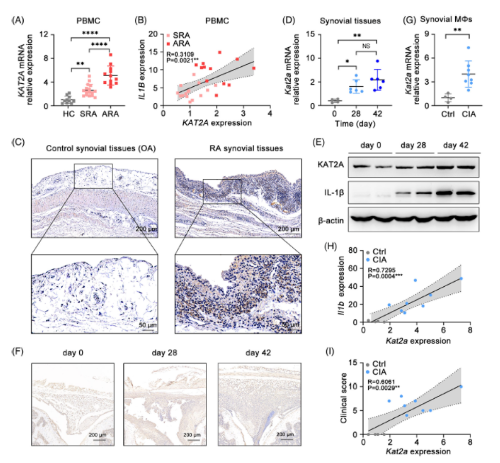
Fig 1. 在RA患者和CIA模型小鼠中,KAT2A表达升高与关节炎症有显著相关性
2. KAT2A抑制剂改善关节炎的炎症病理
给CIA模型小鼠注射选择性KAT2A酶抑制剂MB-3。MB-3显著抑制炎症性关节炎的发展,治疗小鼠的临床评分较低,关节肿胀较轻。microCT显示MB-3减轻了指指骨和腕关节的骨侵蚀程度,从而改善了骨密度和骨体积。此外,膝关节组织学分析显示,给药MB-3后CIA模型小鼠关节囊肿胀减轻,滑膜增生减轻,膝关节炎症细胞浸润减少。Safranin O染色发现,KAT2A抑制也抑制了CIA小鼠膝关节软骨的破坏。以上数据表明,抑制KAT2A可显著减轻关节炎的病理损伤,提示KAT2A是关节炎的关键致病因子。
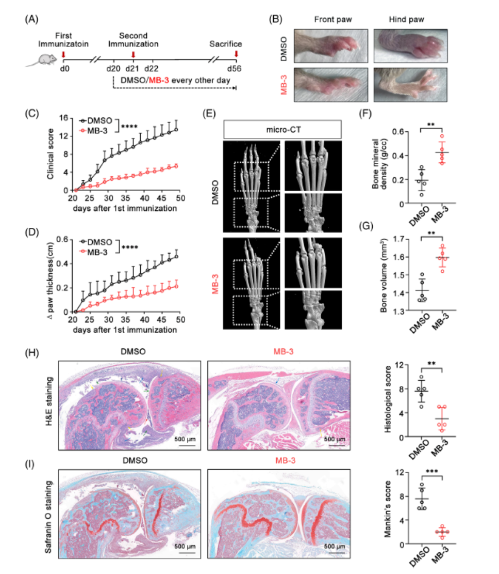
Fig 2. KAT2A抑制剂可减轻CIA模型小鼠的炎症病理和组织损伤
3. KAT2A抑制剂抑制CIA模型小鼠炎症和免疫紊乱
免疫失调在很大程度上决定了RA的发病机制。对照组CIA小鼠的病理性脾肿大在MB-3给药后得到改善,这表明KAT2A抑制可能直接影响CIA模型的炎症病。分析了血清中促炎细胞因子的分泌。给药MB-3的CIA小鼠血清中IL-1β、IL-6和TNF-α浓度显著降低。MB-3处理的CIA小鼠中,CD4+和CD8+高表达CD44的T细胞群减少。CIA模型小鼠发现MB-3给药大大降低了Th1和Th17细胞的频率。在MB-3处理小鼠的脾脏和pln发现Tregs频率增加。KAT2A抑制显著降低了CIA模型小鼠脾脏中 Tfh细胞的数量。KAT2A抑制通过抑制促炎细胞因子的产生和纠正随后的T淋巴细胞失衡来改善RA的免疫损伤。
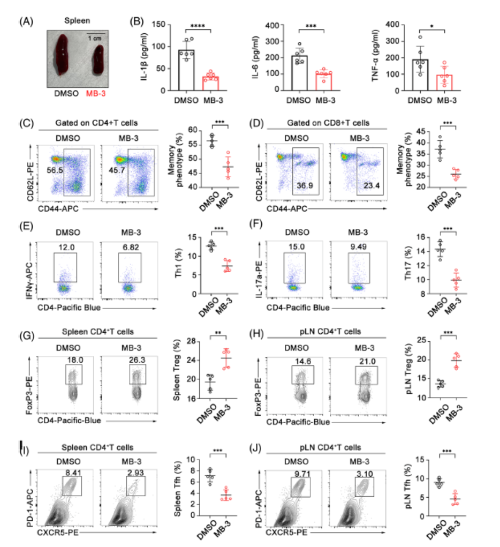
Fig 3. KAT2A抑制剂改善CIA模型小鼠的炎症和免疫紊乱
4. KAT2A抑制剂在体内控制脂多糖(LPS)诱导的全身炎症
通过腹腔注射LPS建立了不依赖于适应性免疫细胞的急性全身炎症模型,LPS触发先天免疫系统,特别是巨噬细胞的激活,包括促炎细胞因子的产生以及炎症细胞的浸润。MB-3预处理改善了LPS诱导的内毒素休克模型肺组织的炎症损伤,改善了炎症细胞浸润和出血的病理改变,MB-3预处理导致内毒素休克模型血清细胞因子IL-1β、IL-6、TNF-α浓度大幅降低。腹腔注射LPS可触发由炎性巨噬细胞及其分泌促炎细胞因子驱动的腹膜炎模型。通过流式细胞术分析腹膜细胞群,发现MB-3预处理抑制LPS小鼠腹腔内F4/80+CD11b+巨噬细胞的浸润。MB-3抑制KAT2A通过调节先天免疫细胞的效应功能,在体内限制LPS诱导的全身性炎症。
5. NLRP3炎性体启动需要KAT2A
通过RNA-seq分析了LPS在DMSO或MB-3处理的小鼠骨髓源性巨噬细胞(BMDMs)中诱导的全局基因表达谱。KAT2A抑制导致促炎基因的大量减少。与DMSO处理的BMDM相比,MB-3处理导致RA功能基因的显著表达差异,这与体内CIA模型的结果一致。MB-3处理介导的差异表达基因也在NLRP3炎症小体通路中富集。KEGG通路显示,上调基因在NF-κB信号、nod样受体信号、细胞因子-细胞因子受体和RA中富集。
MB-3处理抑制LPS诱导的IL-1β和NLRP3基因转录呈剂量依赖性,免疫印迹分析也证实了这一点。MB-3处理也抑制了不同LPS刺激时间下IL-1β和NLRP3 mRNA和蛋白的表达水平。MB-3对IL-6的转录和分泌具有抑制作用,这也证实了RNA-seq的结果。用特异性siRNA沉默KAT2A可显著抑制IL- 1β和NLRP3的诱导表达。为了深入研究KAT2A的功能,利用另外两种KAT2A特异性抑制剂CPTH2和PU139来观察它们对巨噬细胞活化的影响。这两种抑制剂的治疗都抑制了脂多糖诱导的BMDMs中Il1b和Nlrp3的转录,免疫印迹实验也证实了这一点。CPTH2或PU139对KAT2A的药理学抑制也会抑制NLRP3炎症小体的启动。KAT2A通过LPS刺激促进Il1b和Nlrp3的诱导表达,这对于NLRP3炎性小体的体外启动是必不可少的。
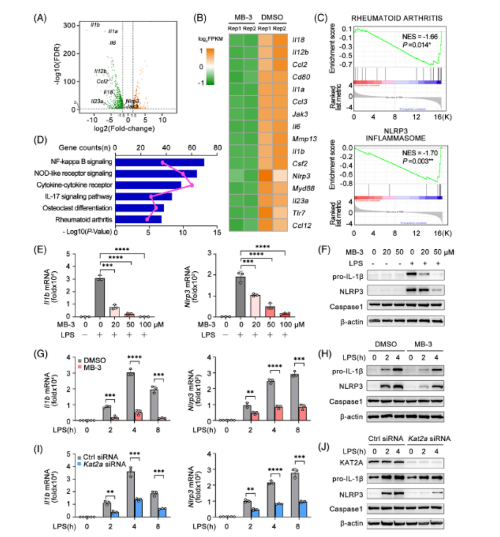
Fig 4. 在启动阶段,NLRP3炎性体的激活需要KAT2A
6. KAT2A促进NLRP3炎性小体依赖性IL-1β加工
用三磷酸腺苷(ATP)、尼日利亚菌素(Nigericin)和尿酸钠(MSU)等NLRP3炎症小体激活剂处理LPS启动的巨噬细胞,观察KAT2A抑制剂或敲除对NLRP3炎症小体的影响。MB-3处理有效地降低了ATP、尼日利亚菌素或MSU刺激后IL-1β的分泌,但对TNF-α的分泌没有影响。
巨噬细胞中IL-6的分泌也被MB-3处理抑制,以响应LPS启动和ATP、Nigericin或MSU的刺激。KAT2A沉默导致促炎细胞因子如IL-1β和IL-6的产生减少,但TNF-α的产生没有减少。Caspase 1的裂解是炎性小体加工和分泌IL-1β的关键步骤。通过检测培养巨噬细胞上清中caspase 1和IL-1β的蛋白表达,研究了KAT2A对NLRP3炎性体活化的影响。结果表明,MB-3处理可以剂量依赖性地抑制ATP或尼日利亚蛋白刺激后前il -1β和caspase 1蛋白的裂解。M B - 3处理以剂量依赖的方式显著抑制ASC寡聚化。免疫荧光(IF)检测显示,尼日利亚菌素处理LPSprimed巨噬细胞可产生ASC斑点样寡聚物结构,MB-3处理可抑制ASC斑点样寡聚物结构的形成。
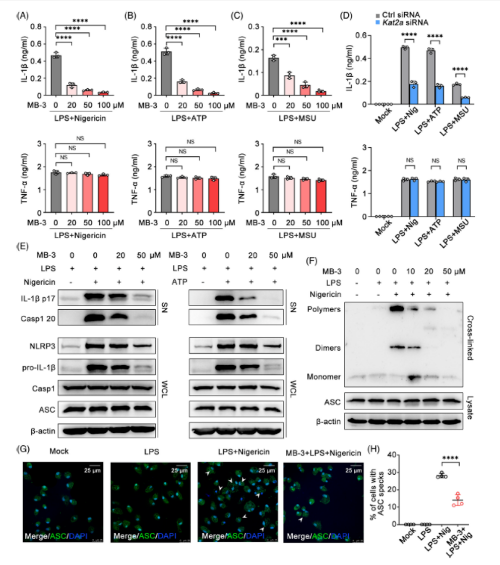
Fig 5. KAT2A促进NLRP3炎性体组装和IL-1β加工
7. KAT2A通过抑制NRF2通路支持炎性巨噬细胞的代谢重编程
MB-3处理显著抑制LPS刺激BMDMs的细胞ROS生成。巨噬细胞通过代谢重编程来促进巨噬细胞效应功能,以应对各种炎症刺激。在LPS激活的巨噬细胞中,TCA明显断裂导致线粒体呼吸受损和糖酵解增强。LPS刺激导致ATP和乳酸的产生增加,而MB-3处理则降低了ATP和乳酸的产生,表明LPS触发的线粒体呼吸向厌氧糖酵解的转换受到MB-3的破坏。通过直接测定LPS刺激的巨噬细胞在处理或不处理MB-3的情况下的细胞外酸化率(ECAR)来评估细胞糖酵解水平。结果显示,MB-3治疗显著降低了巨噬细胞的基础和最大ECAR,证实了MB-3治疗后糖酵解水平受。
为了揭示KAT2A对巨噬细胞代谢重编程的潜在机制,重新分析了MB-3或DMSO预处理的LPS活化BMDM的RNA-seq数据,发现差异表达基因在NRF2通路中富集, MB-3处理的BMDM中,许多上调基因与NRF2功能和转录活性相关,与GSEA结果一致。MB-3处理诱导LPS激活的BMDM中NRF2蛋白表达上调。用特异性siRNA在BMDMs中沉默NRF2的表达,然后用MB-3处理NRF2沉默的BMDMs和对照BMDMs,研究NRF2参与IL-1β的转录和蛋白质合成。虽然MB-3对对照BMDMs有明显的抑制作用,但对NRF2沉默BMDMs中NLRP3炎性小体的启动(包括NLRP3)和il -1β前蛋白的合成没有影响。这些结果表明,MB-3对炎症反应的抑制作用依赖于NRF2的上调及其抗炎作用。
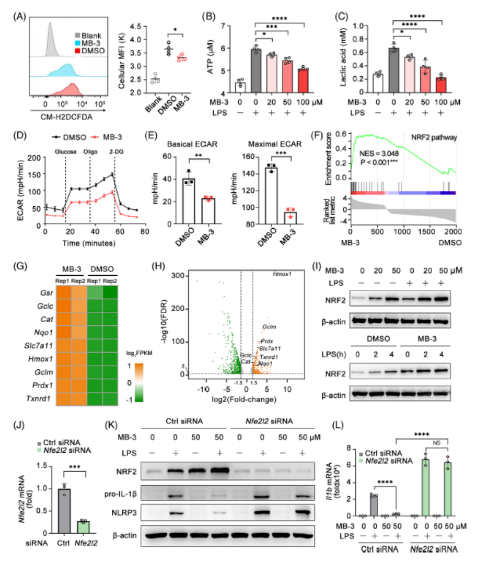
Fig 6. KAT2A介导的NRF2通路抑制允许炎症巨噬细胞的代谢重编程
8. KAT2A协调组蛋白乙酰化与NRF2转录活性,用于Il1b和Nlrp3转录
分别转染含有Il1b启动子、Nlrp3启动子或Tnf启动子的荧光素酶报告质粒,进行了双荧光素酶报告基因检测。MB-3剂量依赖性地抑制traf6诱导的Il1b和Nlrp3启动子激活,但对Tnf启动子激活影响不大。来自公共数据库的ChIP-seq分析显示,在LPS刺激的巨噬细胞中,NRF2特异性结合Il1b和Nlrp3的启动子,其中NRF2影响H3K9ac水平使用NRF2抗体或H3K9ac抗体进行ChIP-qPCR检测。作为阳性对照,MB-3处理显著促进了Nqo启动子上NRF2的富集。MB-3处理也增强了NRF2对Il1b和Nlrp3启动子的富集,表明NRF2转录抑制因子活性升。同时,使用H3K9ac抗体的ChIP-qPCR结果显示,MB-3抑制KAT2A也降低了Il1b和Nlrp3启动子上的H3K9ac水平,表明MB-3处理介导的转录激活能力丧失。MB-3协调了受抑制的组蛋白H3K9ac修饰和NRF2转录抑制因子活性的增强,以控制Il1b和Nlrp3 mRNA的表达。KAT2A通过抑制NRF2介导的代谢重编程,驱动炎性巨噬细胞NLRP3炎性小体的异常激活和IL-1β的过量产生,导致RA的进行性关节损伤。
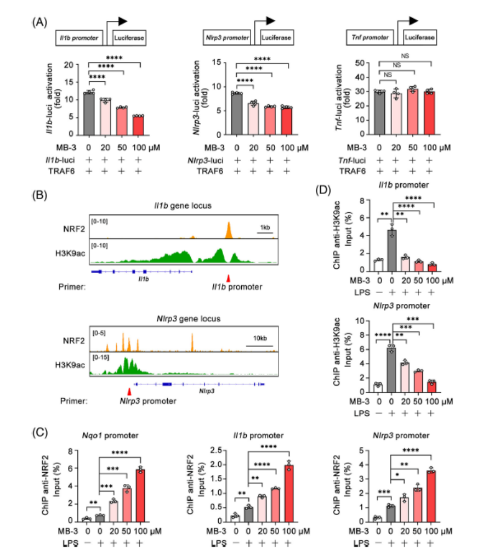
Fig 7. KAT2A协调组蛋白乙酰化和NRF2转录活性,促进Il1b和Nlrp3的表达
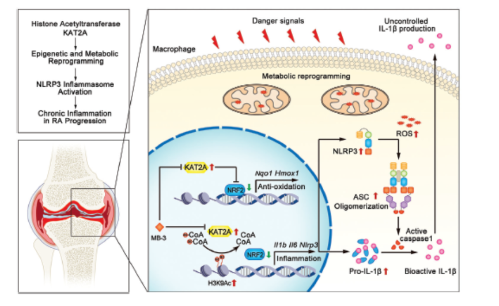
Fig 8. KAT2A在炎性巨噬细胞表观遗传和代谢重编程中的图示
参考文献:
Zhang Y, Gao Y, Ding Y, Jiang Y, Chen H, Zhan Z, Liu X. Targeting KAT2A inhibits inflammatory macrophage activation and rheumatoid arthritis through epigenetic and metabolic reprogramming. MedComm (2020). 2023 Jun 11;4(3):e306. doi: 10.1002/mco2.306IF: 9.9 . PMID: 37313329; PMCID: PMC10258526.
