关于催化剂的基本概念----阿拉丁试剂
作者:上海阿拉丁生化科技股份有限公司 2023-07-04T11:20 (访问量:18843)
过渡态理论[1]
过渡态理论,也称活化复合体理论或绝对反应速率理论,是对化学反应和其他过程的研究,认为它们是通过组成原子和分子的相对位置和势能的连续变化来进行的。在原子或分子的初始排列和最终排列之间的反应路径上,存在一种中间态,处于这个中间态时,势能达到最大值。这个最大值对应的构型被称为活化络合物,它的状态被称为过渡状态。过渡态能量与初始态能量的差值与反应的实验活化能密切相关;它表示反应或流动系统为进行转换必须获得的最小能量。在过渡态理论中,活化络合物被认为是在与处于初始状态的原子或分子的平衡状态下形成的,因此可以确定其统计和热力学性质。达到终态的速率由形成的激活复合物的数量和它们进入终态的频率决定。对于简单的系统,这些量可以用统计力学原理计算出来。用这种方法,化学或物理过程的速率常数可以用原子和分子的尺寸、原子质量和原子间或分子间的力来表示。过渡状态理论也可以用热力学术语来表述。

图1:势能曲线
活化能是指在化学反应中将反应物转化为产物所需的最小能量。活化能的值等于处于中间构型(称为过渡态或活化络合物)的粒子与处于初始态的反应物粒子之间的位能差。因此,活化能可以看作是反应物在生成生成物之前必须克服的障碍。
反应热[2]
反应热,也叫反应焓,在化学反应过程中,为了使所有物质在相同的温度下存在,必须增加或除去的热量。如果反应系统容器中的压力保持恒定值,则测量的反应热也表示随反应过程而发生的热力学量的变化,称为焓或热含量。即反应结束时物质的焓与反应开始时物质的焓之差。因此,在恒压下确定的反应热也被指定为反应焓,用符号ΔH表示。若反应热为正,则称该反应为吸热反应;如果是负的,则是放热的。
伴随化学变化的热效应的预测和测量对于理解和运用化学反应是很重要的。如果包含反应系统的容器隔热程度非常高,没有热量流入或流出系统(绝热状态),则伴随转化的热效应可能表现为温度的升高或降低(视具体情况而定)。确切的反应热值对于正确设计化学过程中使用的设备是必要的。
因为对每一个反应进行热测量是不现实的,而且对某些反应这样的测量甚至可能是不可行的,所以习惯上是从已编制的标准热数据的适当组合来估计反应的热。这些数据通常采用标准生成热和燃烧热的形式。标准生成热的定义是:当1摩尔化合物由其组成元素形成时,每种物质在其正常物理状态(气体、液体或固体),在25°C(77°F)和1大气压下吸收或演化的热量。元素的生成热可以随意地赋值为零。标准燃烧热的定义与此类似,即1摩尔物质在过量的氧气中燃烧时,在25°C和一大气压下所产生的热量。从测量的生成热和燃烧热计算反应热的方法是基于热总和的原理称为赫斯定律。
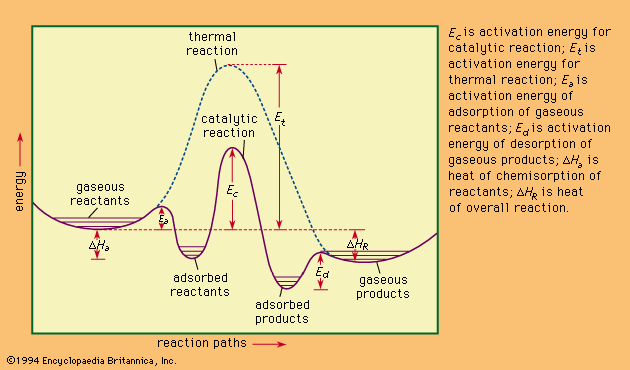
图2:催化和热反应(非催化)反应的能量分布
催化剂[3]
催化剂是在化学中经常使用到的一种物质,能在不消耗自身的情况下加快反应进度。酶是自然发生的催化剂,负责许多基本的生化反应的进程加速。
大多数固体催化剂是金属或金属元素以及半金属元素硼、铝和硅的氧化物、硫化物和卤化物。气态和液态催化剂通常以其纯物质形式或与适当的载体或溶剂结合使用;固体催化剂通常分散在其他被称为催化剂载体的物质中。
一般来说,催化作用是催化剂和反应物之间的化学反应,形成化学中间体,这些中间体能够更容易地相互反应或与另一种反应物反应,以形成所需的最终产物。在化学中间体和反应物之间的反应中,催化剂被再生。催化剂和反应物之间的反应模式变化很大,在固体催化剂中往往是复杂的。典型的这些反应有酸碱反应、氧化还原反应、配位络合物的形成和自由基的形成。对于固体催化剂,反应机理受到表面性质和电子或晶体结构的强烈影响。某些固体催化剂,称为多功能型催化剂,能够与反应物发生多种形式的相互作用;双功能催化剂则被广泛应用于石油工业的重整反应。
催化反应是许多工业化学过程的基础,且催化剂制造本身就是一个快速发展的工业过程。
催化过程及其催化剂 | |
催化过程 | 对应所使用的催化剂 |
氨的合成 | 铁 |
硫酸的生产 | 氮(II)氧化物、铂 |
石油裂解 | 沸石 |
不饱和烃的加氢反应 | 镍、铂或钯 |
汽车尾气中碳氢化合物的氧化 | 氧化铜、氧化钒、铂、钯 |
正丁烷向异丁烷的异构化 | 氯化铝、氯化氢 |
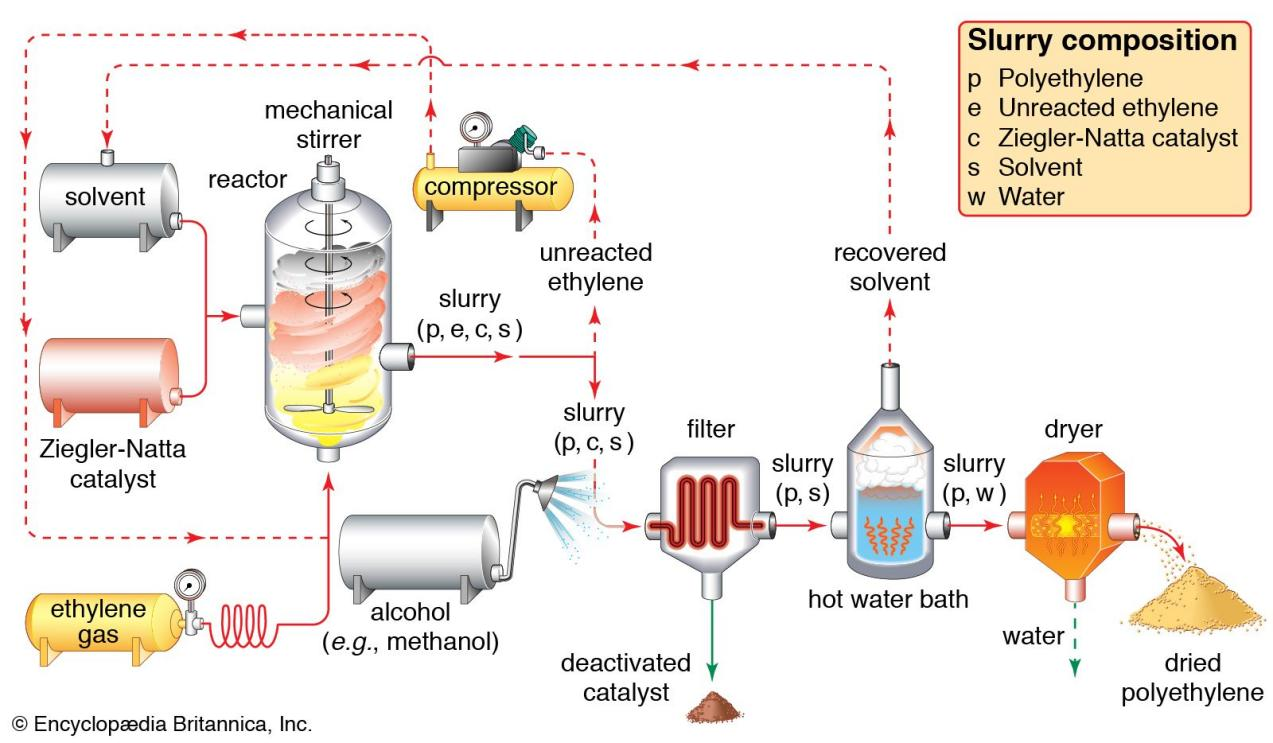
图3:乙烯聚合工业中用到的齐格勒-纳塔催化剂
乙烯气体在压力下被泵入反应容器,在该反应容器中,它在齐格勒-纳塔催化剂的影响下,在溶剂存在下进行聚合。一种由聚乙烯、未反应的乙烯单体、催化剂和溶剂组成的浆液从反应器中流出。未反应的乙烯被分离并返回反应器,而催化剂被酒精洗涤中和并过滤。多余的溶剂从热水浴中回收并回收,干燥器将湿聚乙烯脱水为其最终的粉末形式。
化学中间体[4]
化学中间体,指在某些反应物转化为产物过程中产生的任意化学物质。大多数合成过程都涉及通过一系列步骤将一些现成的、通常价格较为低廉的物质转化为所需的产品。一个步骤产生并用于后续步骤的所有物质都被认为是中间体。
除了在中间不稳定分子生成时停止反应的物质可以作为产物回收的物质外,有些化学物质即使还没有被分离出来,也已知或假设为中间体。在一般不稳定的中间体的类别中,被研究最为充分的是自由基、碳烯和碳离子。这些中间体属于是分子的高度活性碎片,通常只在很短的时间内保持不结合。
参考文献
1. Laidler, Keith J.. "transition-state theory". Encyclopedia Britannica, 23 Sep. 2019, https://www.britannica.com/science/transition-state-theory.
2. Britannica, The Editors of Encyclopaedia. "heat of reaction". Encyclopedia Britannica, 25 Aug. 2022, https://www.britannica.com/science/heat-of-reaction.
3. Britannica, The Editors of Encyclopaedia. "catalyst". Encyclopedia Britannica, 30 Oct. 2022, https://www.britannica.com/science/catalyst.
4. Britannica, The Editors of Encyclopaedia. "chemical intermediate". Encyclopedia Britannica, 20 Jul. 1998, https://www.britannica.com/science/chemical-intermediate.
阿拉丁相关产品列表

