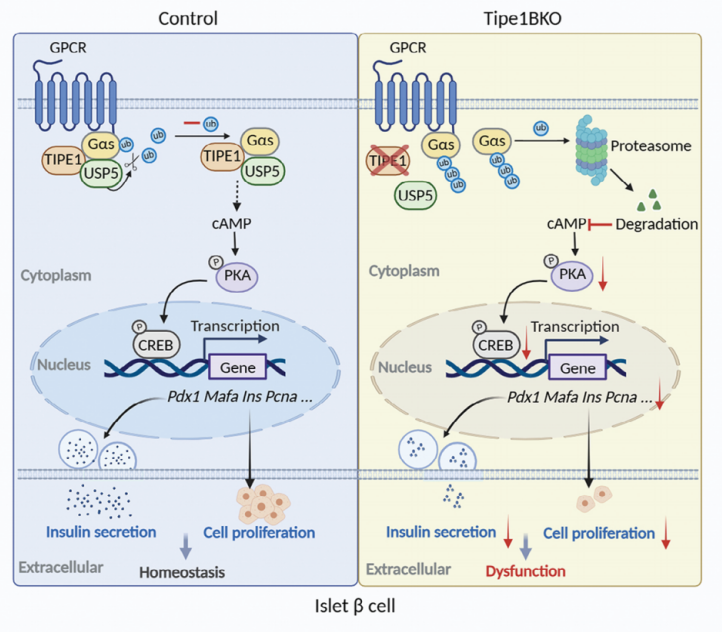
2024年2月28日,山东大学基础医学院马春红、高立芬研究团队在Advanced Science(中科院一区TOP/JCR Q1,5年IF=16.7)上发表题为“Beta-Cell Tipe1 Orchestrates Insulin Secretion and Cell Proliferation by Promoting Gαs/cAMP Signaling via USP5”的研究论文,揭示了Tipe1分子调控胰岛β细胞稳态抑制糖尿病进展的新型生物学功能,Tipe1通过去泛素酶USP5抑制k48连接的Gαs的泛素化降解进而调控β细胞的增殖和功能,表明Tipe1可能是T2D干预的新治疗靶点。

01
01 研究背景
胰腺β细胞在维持胰岛素分泌和葡萄糖稳态中起着至关重要的作用,β细胞质量和胰岛素分泌不足是2型糖尿病(T2D)发展的必要条件。TNF-α诱导的蛋白8-like 1 (Tipe1)在多种疾病中起着至关重要的作用,并在正常小鼠的胰岛中高度表达,然而其在T2D发病机制中的特定作用仍未被广泛探索。
02 研究结果
1、β细胞中Tipe1敲低导致小鼠严重的糖尿病表型
作者研究发现在生理条件下,胰岛β细胞中Tipe1的表达与关键胰岛素相关基因的表达呈正相关。为评估Tipe1在β细胞中的作用,作者构建了β细胞特异性Tipe1缺陷(Ins2-Tipe1BKO)小鼠。与对照组相比,Ins2-Tipe1BKO小鼠胰岛中Tipe1的表达明显降低,实验表明β细胞中Tipe1的缺乏会损害小鼠葡萄糖稳态。作者进一步构建了β细胞条件性敲除Tipe1的db/db小鼠,即Ins2-Tipe1BKO-db/db小鼠,研究发现Tipe1条件性缺乏会导致db/db小鼠胰岛素分泌不足。有证据表明,糖尿病前期或糖尿病患者的特点是呼吸交换率(RER)降低和代谢不灵活,为了研究Ins2Tipe1BKO-db/db小鼠比db/db小鼠血糖水平更高、体重更轻的原因,通过检测两类小鼠食物摄入量、饮料摄入量和能量消耗以及胰岛变化,发现db/db小鼠β细胞中Tipe1的缺乏加速了T2D条件下β细胞损失和胰岛素不足。此外,作者发现Tipe1的缺失降低了β细胞在HFD刺激下的代偿性增殖,导致β细胞质量不足。

图1. 在db/db小鼠中,β细胞中Tipe1敲低导致严重的糖尿病表型
2、Tipe1促进β细胞增殖和胰岛素分泌
为了更好地了解β细胞中Tipe1缺失的影响,作者使用分离的胰岛和MIN6 β细胞系来检查Tipe1是否可以以细胞自主的方式调节β细胞功能。从Ins2-Tipe1BKO和Ins2-Cre小鼠中分离出原代胰岛,在体外条件下用不同浓度葡萄糖处理,发现Ins2-Tipe1BKO小鼠胰岛细胞内胰岛素水平降低。此外,当用较高浓度葡萄糖刺激胰岛时,Ins2-Tipe1BKO小鼠的胰岛素分泌明显减少。与Ins2-Cre小鼠相比,Ins2-Tipe1BKO小鼠胰岛中胰岛素相关基因的表达一致降低。在MIN6细胞中敲低或增加Tipe1的表达,发现Tipe1敲低的MIN6细胞增殖下降,而Tipe1过表达的MIN6细胞增殖增加。通过分离Ins2-Tipe1BKO和对照小鼠原代胰岛,发现Tipe1敲除小鼠胰岛中的增殖相关标志物减少。有证据表明,长时间(3-6个月)暴露于高脂环境可以增加β细胞的增殖。与对照组相比,Ins2-Tipe1BKO-HFD和Ins2-Tipe1BKO-db/db小鼠的β细胞增殖显著降低。作者进一步利用腺病毒进行Tipe1拯救实验发现Tipe1过表达可以逆转其缺失引起的表型,表明Tipe1以细胞自主的方式促进β细胞增殖和胰岛素分泌。
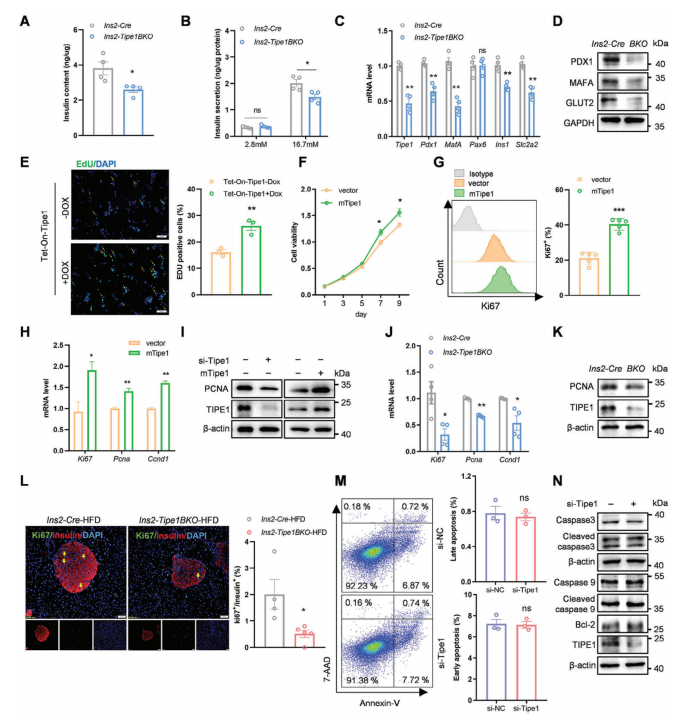
图2. Tipe1以细胞自主的方式促进β细胞增殖和胰岛素分泌
3、Tipe1通过Gαs/cAMP通路维持β细胞功能
接下来,作者进一步探究了Tipe1调节胰岛β细胞的分子机制,利用IP/质谱法,在β细胞中发现了大量潜在的Tipe1相互作用蛋白,并对已报道的人类IGT(糖耐量受损)和T2D胰岛(GSE50398)中不同表达的基因进行聚类分析。根据分析结果,作者进一步探究了Tipe1与Gαs(由Gnas编码)或GΑSP1(由Gprasp1编码)的相互作用。同时,共聚焦实验进一步验证了Tipe1和Gαs在MIN6细胞中的共定位。为了证实Gαs是否与Tipe1介导的胰岛β细胞调控有关,将过表达Gnas的腺病毒转导Tipe1沉默的MIN6细胞和Ins2-Tipe1BKO小鼠的胰岛,发现Gnas的过表达逆转了MIN6细胞的增殖。此外,在Ins2-Tipe1BKO和Ins2-Tipe1BKO-db/db小鼠的胰岛中,高糖刺激的胰岛素分泌也被Gnas过表达所逆转,表明Gαs参与Tipe1介导的β细胞调控。作者进一步研究发现Tipe1通过Gαs/cAMP途径调节β细胞增殖和胰岛素分泌。
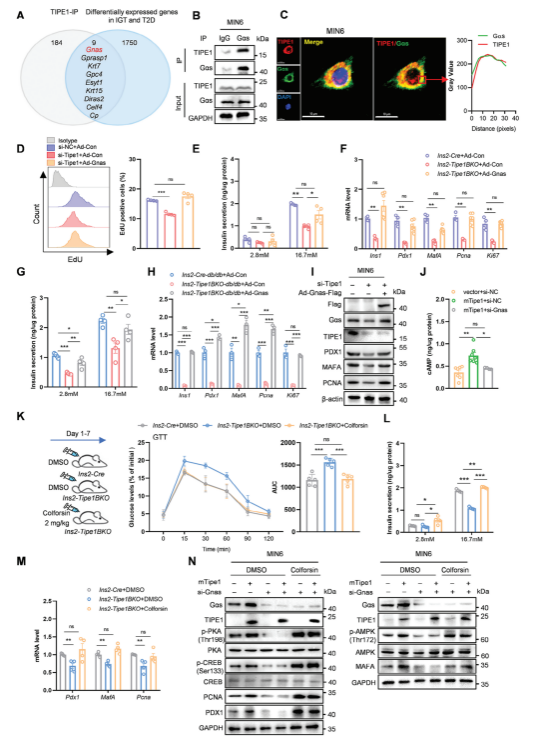
图3. Tipe1通过Gαs/cAMP通路调控β细胞功能
4、Tipe1通过抑制k48连接的泛素化降解来稳定Gαs
作者进一步证实了Tipe1与Gαs的相互作用,并且发现Tipe1通过阻断Gαs蛋白酶体降解来增强Gαs的丰度。通过对与Tipe1存在潜在相互作用的蛋白进行分析,发现这些蛋白参与了RNA剪接、蛋白质转运和蛋白质泛素化过程的调节,有报道称,Tipe1可以抑制其结合蛋白的多泛素化,Gαs在K28位点有乙酰化修饰,但没有证据表明Gαs的泛素化修饰。然后,作者试图确定Tipe1是否可以调节Gαs的泛素化修饰。首先检测了内源性Gαs在HEK293T和MIN6细胞中的泛素化积累,发现免疫沉淀的Gαs蛋白存在泛素化修饰,同时Tipe1过表达抑制内源性和外源性Gαs蛋白的泛素化积累,而Tipe1敲低可促进Gαs泛素化。一致地,Tipe1过表达抑制了MIN6细胞中k48连接的Gαs泛素化,而敲低Tipe1逆转了上述作用。进一步确定了Gαs的泛素化位点,过表达Tipe1降低了Gαs在8、28和96位的泛素化,这表明Gαs的三个赖氨酸残基(K8、K28和K96)负责Tipe1介导的Gαs多泛素化。进一步研究表明Tipe1通过USP5抑制Gαs泛素化降解。
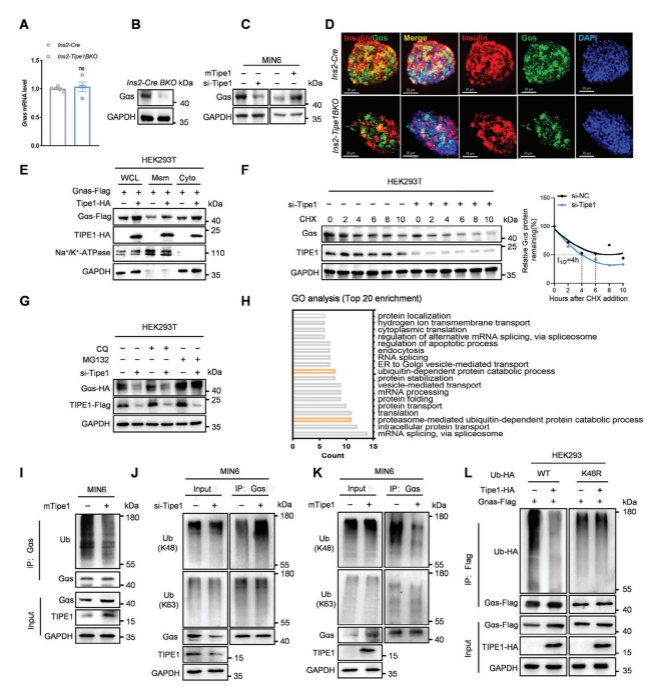
图4. Tipe1通过抑制k48连接的泛素化来稳定Gαs
03 小结
本研究确定了Tipe1在调节β细胞稳态中的关键作用,首次报道了Tipe1调节Gαs的泛素化修饰,并通过去泛素化酶USP5抑制Gαs的多泛素化,从而稳定Gαs,提高了cAMP的下游水平,表明Tipe1可能成为T2D干预的新靶点。